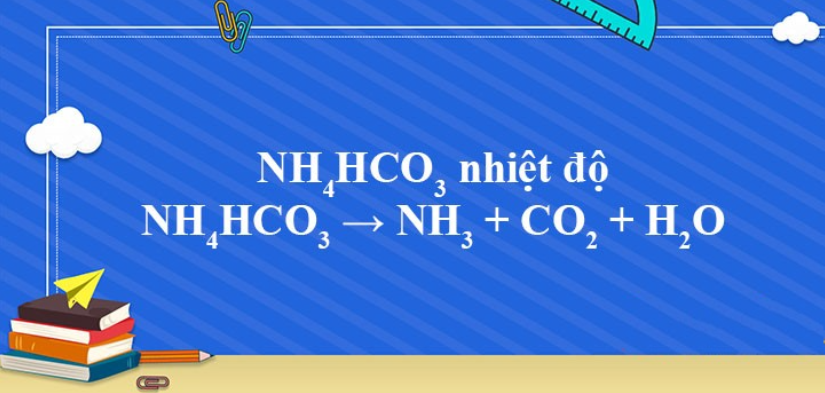
Phản ứng NH4HCO3 → NH3 + CO2 + H2O
1. Phương trình phản ứng NH4HCO3 ra NH3
NH4HCO3 → NH3 + CO2 + H2O
2. Điều kiện phản ứng NH4HCO3 ra CO2
Nhiệt độ
3. Hiện tượng phân hủy NH4HCO3
NH4HCO3 bị phân hủy dần dần giải phóng khí NH3 và khí CO2.
4. Bài tập vận dụng liên quan
Câu 1. Cho một muối M tác dụng với dung dịch KOH dư sinh ra khí có mùi khai, tác dụng với dung dịch BaCl2 sinh ra kết tủa trắng không tan trong HNO3. X là muối nào?
A. (NH4)2CO3
B. (NH4)2SO3
C. NH4HSO4
D. (NH4)3PO4
Lời giải:
Câu 2. Thực hiện thí nghiệm sau: cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Sau phản ứng quan sát được hiện tưởng gì xảy ra?
A. Có kết tủa trắng
B. Không có hiện tượng
C. Có khí mùi khai bay lên
D. Có khí mùi khi bay lên và có kết tủa keo trắng
Lời giải:
Câu 3. Có thể nhận biết NH3 bằng thuốc thử nào sau đây?
A. Quỳ tím ẩm
B. NaOH
C. H2SO4
D. Br2
Lời giải:
Câu 4. Cho các muối sau: MgCO3, BaCO3, Ca(HCO3)2, NaHCO3, Na2CO3, K2CO3. Số muối bị nhiệt phân hủy là
A. 6
B. 4
C. 5
D. 3
Lời giải:
Câu 5. Dẫn 4,48 lít NH3 (đktc) đi qua ống đựng 64 gam CuO nung nóng thu được chất rắn X và khí Y. Ngâm chất rắn X trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng? Coi hiệu suất quá trình phản ứng là 100%.
A. 1 lít
B. 0,5 lít
C. 0,25 lít
D. 1,25 lít
Lời giải:
nNH3 = 0,2 mol, nCuO= 0,8 mol.
Phương trình phản ứng:
2NH3 + 3CuO → 3Cu + N2 + 3H2O (1)
mol: 0,2 0,8 → 0,3
=> nCuO dư= 0,8 - 0,3 = 0,5 mol
A gồm Cu (0,3 mol) và CuO dư (0,5 mol)
Phản ứng của A với dung dịch HCl :
CuO + 2HCl → CuCl2 + H2O (2)
mol: 0,5 → 1
Theo (2) và giả thiết ta suy ra: VHCl = = 0,5 lít.
Câu 6. Muối NH4Cl tác dụng được với dung dịch chất nào sau đây?
A. NaOH, HNO3
B. HNO3, AgNO3
C. NaOH, AgNO3
D. NaNO3, HNO3
Lời giải:
Đáp án: C
Phương trình phản ứng minh họa:
NH4Cl + NaOH → NH3 + H2O + NaCl
NH4Cl + NaCO3 → 2NaCl + CO2 + H2O + 2NH3
Câu 7.Oxi hóa 6 lít NH3 (tạo ra N2 và NO theo tỉ lệ mol 1 : 4) cần vừa đủ V là không khí ( chứa 20% oxi về thể tích). Các thể tích đó ở cùng điều kiện. Giá trị của V là
A. 6,5.
B. 22,5.
C. 32,5.
D. 24,5.
Lời giải:
Đáp án: C
12NH3 + 13O2 → 8NO + 2N2 + 18H2O
VO2 = (6 x 13) / 12 = 6,5 mol
⇒ Vkk = 6,5 : 20% = 32,5 lít
Xem thêm các phương trình hóa học khác:
NH3 + H2O → NH4OH | NH3 ra NH4OH
NH3 + O2 → NO + H2O | NH3 ra NO
Câu 6. Hòa tan hoàn toàn m gam Al trong dung dịch HNO3 loãng thu được 1,12 lít hỗn hợp X gồm 3 khí NO, N2O, N2 có tỉ lệ số mol là: 1 : 2 : 2. Giá trị của m là:
A. 5,4 gam.
B. 3,51 gam.
C. 2,7 gam.
D. 8,1 gam.
Lời giải:
Ta có số mol của hỗn hợp khí thu được sau phản ứng là: = 0,05 (mol)
Theo đề bài, tỉ lệ mol của 3 khí NO; N2O; N2 là 1 : 2 : 2
=> nNO = 0,01 mol; nN2O= 0,02 mol; nN2= 0,02 mol.
Áp dụng định luật bảo toàn electron:
3 . nAl = 3.nNO+ 8.nN2O + 10.nN2 = 3 . 0,01 + 0,02 . 8 + 0,02 . 10 = 0,39
=> nAl= 0,13 mol => mAl = 3,51 gam
Câu 7. Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng với dung dịch HNO3 dư, thu được 1,12 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối so với hiđro bằng 20. Tổng khối lượng muối nitrat sinh ra là :
A. 66,75 gam.
B. 33,35 gam.
C. 6,775 gam.
D. 3,335 gam.
Lời giải:
nhỗn hợp khí= = 0,05 mol
Khối lượng mol trung bình của hỗn hợp khí là: 20.2 = 40 (gam/mol)
Gọi số mol của NO; NO2 lần lượt là a , b mol
Ta có hệ phương trình:
a + b = 0,05
= 40
Giải hệ phương trình được:
=> a = 0,01875; b = 0,03225
=> số mol e trao đổi là: 3a + b = 0,0875 (mol)
=> mmuối tạo thành sau phản ứng là: mFe + mNO3- = 1,35 + 0,0875 . 62 = 6,775 gam
Xem thêm các phương trình hóa học khác:
NH4NO3 + Ba(OH)2 → Ba(NO3)2 + NH3 + H2O
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
(NH4)2SO4 + BaCl2 → NH4Cl + BaSO4