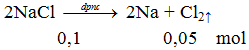Phản ứng: NaCl → Na + Cl2 ↑
1. Phương trình nhiệt phân
2NaCl -dpnc→ 2Na + Cl2
2. Điều kiện phản ứng
- điện phân
3. Cách thực hiện phản ứng
- điện phân nóng chảy NaCl.
4. Hiện tượng nhận biết phản ứng
- Có khí vàng lục, mùi xốc thoát ra ở cực dương.
5. Tính chất hóa học của NaCl
5.1 Loại muối:
NaCl là muối trung hòa - muối mà anion gốc Axit không có khả năng phân li ra ion H+. NaCl có pH = 7 và nó không đổi màu quỳ tím.
5.2 Liên kết hóa học:
NaCl là một liên kết hóa học có bản chất là lực hút tĩnh điện giữa hai ion mang điện tích trái dấu, ở đây là Na+ và Cl–. Liên kết ion được hình thành do lực hút tĩnh điện giữa kim loại điển hình và phi kim điển hình.
5.3 Sự điện li:
NaCl là chất điện li mạnh, phân li hoàn toàn trong nước, tạo ra các ion âm và dương, là ion Na+ và Cl–.
5.4 Sự kết tủa:
Khi cho HCl đặc vào dung dịch bão hòa Natri Clorua sẽ tạo thành kết tủa trắng. Khi thêm nước vào hỗn hợp này, kết tủa sẽ hòa tan lại.
5.5 Các phản ứng tiêu biểu:
NaCl không phản ứng với kim loại, axit, bazơ ở điều kiện thường. Tuy nhiên, NaCl vẫn phản ứng với một muối.
AgNO3
Ở trạng thái rắn, muối NaCl phản ứng với H2SO4 đậm đặc, chúng ta có phương trình phản ứng như sau:
Phản ứng điện phân NaCl:
6. Tính chất vật lí của NaCl
- Muối Nacl là chất rắn tinh thể màu trắng hoặc không màu.
– Muối NaCl không có mùi vị.
– Muối NaCl là chất hấp thụ độ ẩm một cách tự nhiên. Nó hấp thụ độ ẩm từ khí quyển ẩm trên 75% độ ẩm tương đối và dưới ngưỡng này sẽ bay hơi.
7. Bạn có biết
- Cacs ion kim loại kiềm rất khó bị khử nên phải dung dòng điện.
- Phương pháp điện phân nóng chảy dung để điều chế các kim loại hoạt động mạnh như Na, K, Ca…
8. Bài tập liên quan
Câu 1:
Phương pháp nào sau đây dung để điều chế kim loại Na?
A. điện phân nóng chảy NaCl.
B. điện phân dung dịch NaCl.
C. Cho Cu phản ứng với NaCl.
D. Nhiệt phân NaCl.
Hướng dẫn giải
Phương pháp điện phân nóng chảy dung để điều chế các kim loại hoạt động mạnh như Na, K, Ca…
Đáp án A.
Câu 2 :
Thể tích khí ở dktc thoát ra khi điện phân nóng chảy 5,85 gam NaCl là
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Hướng dẫn giải
V = 0,05.22,4 = 1,12 lít.
Đáp án B.
Câu 3 :
Khi điện phân nóng chảy NaCl, khí clo sinh ra ở
A. catot. B. cực âm. C. anot. D. màng ngăn.
Hướng dẫn giải
clo sinh ra ở cực dương hay anot
Đáp án C.
Câu 4 : Cho 26,6 gam hỗn hợp KCl và NaCl hòa tan vào nước để được 500 gam dung dịch. Cho dung dịch trên tác dụng vừa đủ với AgNO3 thì thu được 57,4 gam kết tủa. Thành phần phần trăm theo khối lượng của KCl và NaCl trong hỗn hợp đầu là:
A. 56% và 44%.
B. 60% và 40%
C. 70% và 30%
D. 65% và 35%
Hướng dẫn:
Đáp án A
Câu 5: Cho 3,87 gam hỗn hợp muối natri của hai hologen liên tiếp tác dụng với dung dịch AgNO3 dư thu được 6,63g kết tủa. Hai halogen kế tiếp là:
Hướng dẫn:
NaX + AgNO3 → AgX + NaNO3
mNaX = 3,87 , mAgX = 6,63
Áp dụng PP tăng giảm khối lượng ⇒ nNaX = (6,63-3,87)/(108-23)=0,324 mol
MNaX = 3,87/0,324 = 119,18 ⇒ MX = 96,1
⇒ 2 Halogen liên tiếp thỏa mãn là Br2 và I2
Xem thêm một số phương trình phản ứng hóa học khác:
NH4Cl + AgNO3 → NH4NO3 + AgCl | NH4Cl ra NH4NO3 | AgNO3 ra AgCl
FeCl2 + AgNO3 → Fe(NO3)2 + AgCl |FeCl2 ra AgCl
FeCl3 ra Fe(NO3)3 | FeCl3 + AgNO3 → AgCl ↓+ Fe(NO3)3 | AgNO3 ra AgCl