Đề thi Hóa 8 giữa kì 1 có đáp án (Đề 7)
-
378 lượt thi
-
27 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
Những hạt nào cấu tạo nên nguyên tử của hầu hết các nguyên tố hóa học (trừ hiđro)?
 Xem đáp án
Xem đáp án
Đáp án B
Những hạt cấu tạo nên nguyên tử của hầu hết các nguyên tố hóa học (trừ hiđro) là: Electron, nơtron, proton.
Câu 2:
Chọn các từ thích hợp điền vào “…”
“Phân tử khối là khối lượng của một (1) … tính bằng đơn vị (2) …”
 Xem đáp án
Xem đáp án
Đáp án C
Phân tử khối là khối lượng của phân tử tính bằng đơn vị Cacbon (đvC).
Câu 4:
Dãy nào sau đây chỉ gồm các đơn chất phi kim?
 Xem đáp án
Xem đáp án
Đáp án C
Các đơn chất phi kim là: Oxi, hiđro, clo.
Câu 5:
Nguyên tử trung hòa về điện là do yếu tố nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án D
Nguyên tử trung hòa về điện là do số hạt proton bằng số hạt electron.
Câu 6:
Trong hợp chất nào dưới đây, nguyên tố lưu huỳnh có hóa trị IV?
 Xem đáp án
Xem đáp án
Đáp án B
Gọi x là hóa trị của lưu huỳnh
+ Ở ý A ta có: H2S, theo quy tắc hóa trị ta có: I.2 = 1.x suy ra x = II.
Vậy S hóa trị II
+ Ở ý B ta có: SO2, theo quy tắc hóa trị ta có: 1.x = 2.II suy ra x = IV.
Vậy S hóa trị IV
+ Ở ý C ta có: FeS, theo quy tắc hóa trị ta có: 1.II = 1.x suy ra x = II.
Vậy S hóa trị II
+ Ở ý D ta có: SO3, theo quy tắc hóa trị ta có: x.1 = 3.II suy ra x = VI.
Vậy S hóa trị VI
Câu 8:
Dãy nào sau đây chỉ gồm các hợp chất?
 Xem đáp án
Xem đáp án
Đáp án B
+ Hợp chất là những chất được cấu tạo từ 2 nguyên tố trở lên
+ Dãy chỉ gồm các hợp chất là: CuO, H2SO4, NaCl.
Câu 9:
Vì sao khối lượng của hạt nhân được coi bằng khối lượng của nguyên tử?
 Xem đáp án
Xem đáp án
Đáp án D
Proton và nơtron có cùng khối lượng, còn electron có khối lượng rất bé (chỉ khoảng 0,0005 lần khối lượng của proton), không đáng kể. Vì vậy, khối lượng của hạt nhân được coi là khối lượng của nguyên tử.
Câu 10:
Dựa vào dấu hiệu nào dưới đây có thể phân biệt phân tử của hợp chất khác với phân tử của đơn chất?
 Xem đáp án
Xem đáp án
Đáp án A
Dựa vào dấu hiệu nguyên tử khác loại liên kết với nhau có thể phân biệt phân tử của hợp chất khác với phân tử của đơn chất
Câu 11:
Phát biểu nào sau đây đúng khi nói về hóa trị?
 Xem đáp án
Xem đáp án
Đáp án B
Biểu thức quy tắc hóa trị áp dụng với hợp chất AxBy: x.a = y.b (với a là hóa trị của nguyên tố A, b là hóa trị của nguyên tố B)
A sai vì: Hóa trị của một nguyên tố được xác định theo hóa trị của H chọn làm đơn vị và hóa trị của H là I.
C sai vì: Hóa trị là con số biểu thị khả năng liên kết của các nguyên tử với nhau.
D sai vì: Một nguyên tố có thể có nhiều hóa trị, ví dụ S có thể có các hóa trị II, IV, VI.
Câu 12:
Cho các chất: Cl2, H2SO4, NaOH, Al, O3, C6H12O6, KBr. Có bao nhiêu đơn chất và bao nhiêu hợp chất trong số các chất trên?
 Xem đáp án
Xem đáp án
Đáp án A
+ Đơn chất là: Cl2, Al, O3
+ Hợp chất là: H2SO4, NaOH, C6H12O6, KBr
Câu 13:
Cho sơ đồ cấu tạo của một số nguyên tử sau:
Dãy nào dưới đây lần lượt là số hạt electron của nguyên tử kali, magie, silic?
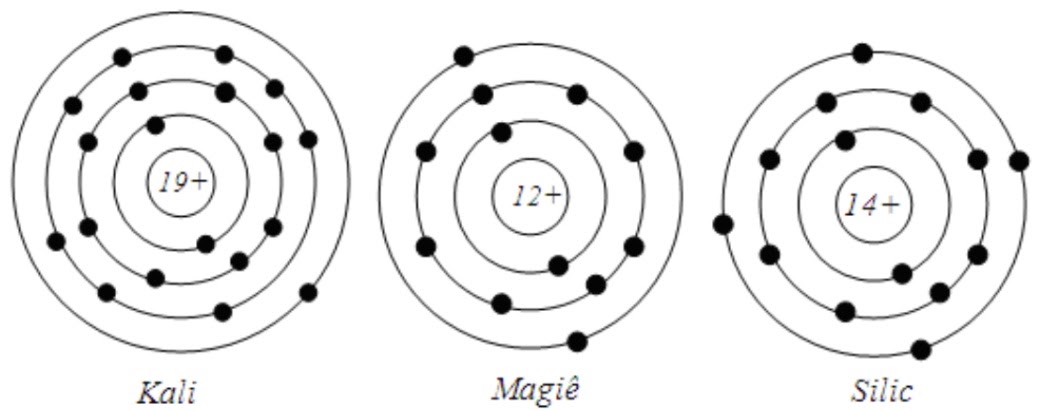
 Xem đáp án
Xem đáp án
Đáp án B
Ta có: Trong nguyên tử, số hạt electron = số hạt proton = số đơn vị điện tích hạt nhân.
⇒ Số hạt electron của nguyên tử kali, magie, silic lần lượt là: 19, 12, 14
Câu 14:
Công thức hóa học nào sau đây viết đúng?
 Xem đáp án
Xem đáp án
Đáp án A
Gọi hóa trị của Na là x, hóa trị của NO3là I
Theo quy tắc hóa trị ta có: x.1 = I.1 suy ra x = I
Vậy Na hóa trị I
Vậy công thức hóa học là: NaNO3
Câu 15:
Kim loại M có hóa trị III, công thức hóa học nào sau đây viết sai?
 Xem đáp án
Xem đáp án
Đáp án C
Công thức hóa học ở ý C viết sai vì:
Ta có công thức hóa học hợp chất là MO
Gọi x là hóa trị của M
Theo quy tắc hóa trị ta có: x.1 = II.1 suy ra x = II.
Vậy với công thức hóa học là MO thì M có hóa trị II (mâu thuẫn với đề bài).
Câu 16:
Phân tử khối của phân tử Fe(OH)3có giá trị nào dưới đây? (Cho biết H = 1, O = 16, Fe = 56)
 Xem đáp án
Xem đáp án
Đáp án D
Phân tử khối của phân tử Fe(OH)3là: 56 + 3.(1+16) = 107 đvC.
Câu 17:
Hợp chất AlxC3có phân tử khối là 144 đvC. Cho biết giá trị đúng của x trong số các giá trị dưới đây? (Cho biết C = 12, Al = 27)
 Xem đáp án
Xem đáp án
Đáp án C
Ta có: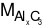 = x.MAl+ 3MC= 144 suy ra x.27 + 3.12 = 144 suy ra x = 4.
= x.MAl+ 3MC= 144 suy ra x.27 + 3.12 = 144 suy ra x = 4.
Câu 18:
Dãy nào sau đây chỉ gồm các đơn chất?
 Xem đáp án
Xem đáp án
Đáp án A
+ Đơn chất là những chất được tạo nên từ một nguyên tố hóa học.
+ Dãy chỉ gồm các đơn chất là: Mg, O2, Na.
Câu 19:
Hóa trị tương ứng của nitơ trong hợp chất NOx(có phân tử khối 46 đvC) là giá trị nào dưới đây? (Cho biết N = 14, O = 16)
 Xem đáp án
Xem đáp án
Đáp án D
Ta có: = MN+ x.MO= 46 suy ra 14 + x.16 = 46 suy ra x = 2
= MN+ x.MO= 46 suy ra 14 + x.16 = 46 suy ra x = 2
Suy ra công thức của hợp chất là NO2
Gọi a là hóa trị của N trong hợp chất, theo quy tắc hóa trị ta có:
a.1 = II.2 suy ra a = IV.
Vậy hóa trị tương ứng của nitơ trong hợp chất là IV
Câu 20:
Nguyên tử X có tổng số hạt proton, nơtron, electron là 52 hạt. Trong hạt nhân nguyên tử X có số hạt không mang điện nhiều hơn số hạt mang điện là 1 hạt. Trong hạt nhân của X có chứa bao nhiêu hạt proton?
 Xem đáp án
Xem đáp án
Đáp án C
Vì nguyên tử X có tổng số hạt là 52
Suy ra p + e + n = 52 mà p = e suy ra 2p + n = 52 (1)
Ta lại có: Số hạt không mang điện nhiều hơn số hạt mang điện là 1 suy ra n - p = 1 (2)
Từ (1) và (2) ta được: p = 17, n = 18 suy ra p = e = 17
Câu 21:
Hợp chất XSO3có phân tử khối bằng 145 đvC. Nguyên tố X là nguyên tố nào trong các nguyên tố sau? (Cho biết O = 16, Mg = 24, Fe = 56, Cu = 64, Zn = 65)
 Xem đáp án
Xem đáp án
Đáp án C
 = 145 = MX+ MS+ 3MO= MX+ 32 + 3.16 = 145 suy ra MX= 65.
= 145 = MX+ MS+ 3MO= MX+ 32 + 3.16 = 145 suy ra MX= 65.
Vậy X là kẽm (Zn)
Câu 22:
Hợp chất có công thức RO2trong đó O chiếm 50% về khối lượng. Nguyên tố R là nguyên tố nào sau đây? (Cho N = 14, O = 16, Si = 28, S = 32, Mn = 55)
 Xem đáp án
Xem đáp án
Đáp án C
Ta có O chiếm 50% về khối lượng.
Mặt khác:
%O = = 50%
= 50%
Suy ra MR = 32 g/mol
Vậy R là nguyên tố lưu huỳnh (S)
Câu 23:
Hợp chất tạo bởi nguyên tố X với nhóm SO4có công thức hóa học là X2(SO4)3và hợp chất tạo bởi nguyên tố Y với nguyên tố H có công thức hóa học là HY. Công thức hóa học nào đúng với hợp chất tạo bởi nguyên tố X và nguyên tố Y?
 Xem đáp án
Xem đáp án
Đáp án A
Ta có: X2(SO4)3
Gọi x là hóa trị của X
Áp dụng quy tắc hóa trị ta có: x.2 = 3.II suy ra x = IIISuy ra X hoá trị III
Tương tự: HY
Gọi y là hóa trị của Y
Áp dụng quy tắc hóa trị ta có: 1.I = 1.y suy ra y = I
Suy ra Y hóa trị I
Gọi công thức hóa học của hợp chất tạo bởi nguyên tố X và nguyên tố Y là XaYb
Theo quy tắc hóa trị ta có: III.a = I.b
Suy ra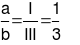 suy ra a = 1, b = 3
suy ra a = 1, b = 3
Vậy công thức hóa học của hợp chất tạo bởi nguyên tố X và nguyên tố Y là: XY3
Câu 24:
Hợp chất tạo bởi nguyên tố Y (hóa trị III) và nguyên tố O. Phân tử hợp chất nặng hơn phân tử hiđro 80 lần. Y là nguyên tố nào trong các nguyên tố sau đây? (Cho biết H = 1, Al = 27, Cr = 52, Fe = 56, Au = 197)
 Xem đáp án
Xem đáp án
Đáp án B
Gọi công thức hóa học của hợp chất là YxOy
Theo quy tắc hóa trị ta có: III.x = II.y
Suy ra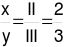 suy ra x = 2, y = 3
suy ra x = 2, y = 3
Vậy công thức hóa học của hợp chất là: Y2O3
Mà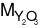 = 80
= 80 = 80.2 = 160 g/mol
= 80.2 = 160 g/mol
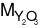 = 2.MY+ 3.MO= 2.MY+ 3.16 = 160 suy ra MY= 56 g/mol
= 2.MY+ 3.MO= 2.MY+ 3.16 = 160 suy ra MY= 56 g/mol
Vậy Y là sắt (Fe)
Câu 25:
Nguyên tử A có tổng số hạt proton, nơtron, electron là 28 hạt. Trong hạt nhân nguyên tử A có số hạt không mang điện xấp xỉ bằng 35,71% tổng số hạt. Nguyên tử A có bao nhiêu hạt electron?
 Xem đáp án
Xem đáp án
Đáp án D
Tổng số hạt trong nguyên tử là: 28 hạt
Suy ra p + n + e = 28 mà p = e suy ra 2e + n = 28 (1)
Trong hạt nhân nguyên tử A có số hạt không mang điện xấp xỉ bằng 35,71% tổng số hạt, hay n =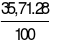
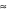 10 hạt
10 hạt
Thay n = 10 vào (1) ta có: 2e + 10 = 28 suy ra e = 9 hạt
Câu 26:
Câu thưởng điểm: Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại A, B là 142 hạt, trong đó tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 42 hạt. Số hạt mang điện của nguyên tử B nhiều hơn nguyên tử A là 12 hạt. Nguyên tử khối của nguyên tử B nặng hơn nguyên tử khối của nguyên tử A 16 đvC. Coi nguyên tử khối có thể được tính bằng tổng số hạt proton cộng với tổng số hạt nơtron. Kim loại A, B là kim loại nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án B
Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại A, B là 142
Suy ra 2pA +nA + 2pB +nB = 142 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 42
Suy ra 2pA + 2pB - (nA+ nB) = 42 (2)
Từ (1) và (2) suy ra 4pA+ 4pB= 184 suy ra pA+ pB= 46 (3)
Số hạt mang điện của nguyên tử B nhiều hơn của A là 12
Suy ra 2pB - 2pA = 12 (4)
Từ (3) và (4) suy ra pA=20, pB= 26
Suy ra A là Ca, B là Fe
Mà MCa= 40, MFe= 56 (thỏa mãn nguyên tử khối của nguyên tử B nặng hơn nguyên tử khối của nguyên tử A 16 đvC)
Vậy A là Ca, B là Fe
Câu 27:
Câu thưởng điểm: Thực nghiệm cho biết nguyên tố sắt chiếm 70% về khối lượng trong một hợp chất với nguyên tố oxi. Phân tử khối của hợp chất trên có giá trị là bao nhiêu?
 Xem đáp án
Xem đáp án
Đáp án D
Gọi công thức của hợp chất là FexOy
Ta có 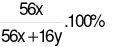 = 70%
= 70%
⇒ 560x = 392x + 112y ⇒ 168x = 112y
⇒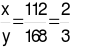 ⇒ x = 2, y = 3
⇒ x = 2, y = 3
Vậy công thức của hợp chất là Fe2O3
Phân tử khối của hợp chất trên là: 2.56 + 3.16 = 160 đvC
