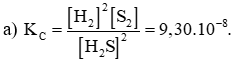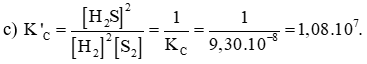Giải SBT Hoá học 11 Bài 9: Ôn tập chương 2
A. 21%.
B. 1%.
C. 78%.
D. 28%.
Lời giải:
Đáp án đúng là: C
Trong khí quyển Trái Đất, khí nitrogen chiếm 78%, khí oxygen chiếm 21%, còn lại là các khí khác chiếm 1%.
A. N2.
B. NH3.
C. SO2.
D. S.
Lời giải:
Đáp án đúng là: B
Khí NH3 được sử dụng làm chất làm lạnh trong các hệ thống làm lạnh công nghiệp.
A. < 5,6.
B. = 7.
C. 6 - 7.
D. > 8.
Lời giải:
Đáp án đúng là: A
Mưa acid là hiện tượng nước mưa có < 5,6 (nước mưa có môi trường acid).
A. ammonia.
B. nitrogen dioxide.
C. nitrogen monoxide.
D. nitrogen.
Lời giải:
Đáp án đúng là: C
Tên gọi của NO là nitrogen monoxide.
A. CO2.
B. H2S.
C. SO2.
D. P2O5
Lời giải:
Đáp án đúng là: C
SO2 là chất khí, mùi hắc, độc (gây ho, viêm đường hô hấp). Trong công nghiệp, SO2 được dùng làm chất tẩy trắng bột gỗ và là nguyên liệu chính để sản xuất sulfuric acid.
A. HBr.
B. HCl.
C. HNO3.
D. H2SO4.
Lời giải:
Đáp án đúng là: D
Do H2SO4 có tính háo nước nên khi tiếp xúc với giấy trắng (có thành phần chính là xenlulozơ) làm tờ giấy hóa đen ở chỗ tiếp xúc.
(C6H10O5)n + H2SO4 → 6nC + H2SO4.5nH2O
A. HNO3.
B. HCl.
C. H3PO4.
D. H2SO4.
Lời giải:
Đáp án đúng là: A
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
A. luyện gang.
B. sản xuất sulfuric acid.
C. chế tạo nam châm điện.
D. tổng hợp dược phẩm.
Lời giải:
Đáp án đúng là: B
Sơ đồ sản xuất H2SO4 từ FeS2.
FeS2 → SO2 →SO3 → H2SO4.
A. Nitrogen.
B. Ammonia.
C. Sulfur dioxide.
D. Hydrogen chloride
Lời giải:
Đáp án đúng là: B
Dung dịch ammonia có môi trường bazơ nên làm phenolphtalein chuyển thành màu hồng.
A. 646,4 mL.
B. 808,0 mL.
C. 715,4 mL.
D. 1095,7 mL.
Lời giải:
Đáp án đúng là: C
Bài 9.11 trang 36 Sách bài tập Hóa học 11: Cho cân bằng hoá học sau:
A. x > y.
B. x = y.
C. x
D. 5x = 4y.
Lời giải:
Đáp án đúng là: A
Phản ứng tỏa nhiệt do nên khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch.
Vậy tổng số mol khí ở 400oC > tổng số mol khí ở 500oC
x > y.
A. NaCl.
B. CaCO3.
C. KClO3.
D. NH4Cl.
Lời giải:
Đáp án đúng là: D
Sau một thời gian đun nóng, NH4Cl bị phân hủy hết tạo thành NH3 và HCl ở dạng hơi.
Bài 9.13 trang 36 Sách bài tập Hóa học 11: Cho các chất sau: H2SO4, SO2, N2, NH3.
Số chất tan tốt trong nước ở điều kiện thường là
A. 4.
B. 1.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: C
Các chất tan tốt trong nước ở điều kiện thường là H2SO4, SO2, NH3.
A. acid.
B. base.
C. chất oxi hoá.
D. chất khử.
Lời giải:
Đáp án đúng là: B
NH3 + HCl → NH4Cl
Trong phản ứng trên, NH3 đóng vai trò là base, HCl đóng vai trò là acid.
Bài 9.15 trang 36 Sách bài tập Hóa học 11: Cho các acid ở dạng đậm đặc sau: HCl, HNO3, H3PO4, H2SO4.
Số acid vừa có tính acid mạnh, vừa có tính oxi hoá mạnh là
A. 1.
B. 4.
C. 3.
D. 2.
Lời giải:
Đáp án đúng là: D
Các acid ở dạng đậm đặc vừa có tính acid mạnh, vừa có tính oxi hoá mạnh là HNO3, H2SO4.
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: A
Thí nghiệm xảy ra phản ứng oxi hoá – khử là:
Mg + H2SO4 → MgSO4 + H2.
Bài 9.17 trang 36 Sách bài tập Hóa học 11:Cho các chất khí sau: H2S, NO, NO2, SO2.
Số khí gây ô nhiễm môi trường khi phát thải vào không khí là
A. 1.
B. 4.
C. 3.
D. 2.
Lời giải:
Đáp án đúng là: B
Các khí gây ô nhiễm môi trường khi phát thải vào không khí là H2S, NO, NO2, SO2.
Bài 9.18 trang 36 Sách bài tập Hóa học 11: Cho cân bằng hoá học sau:
A. tổng số mol khí trong hệ giảm.
B. hiệu suất phản ứng tăng.
C. cân bằng chuyển dịch theo chiều nghịch.
D. nồng độ khí sản phẩm tăng.
Lời giải:
Đáp án đúng là: C
∆H < 0 Phản ứng thuận tỏa nhiệt. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ tức là chiều nghịch.
A. 99,2.
B. 198,3.
C. 297,5.
D. 396,6.
Lời giải:
Đáp án đúng là: B
Bài 9.20 trang 37 Sách bài tập Hóa học 11: Cho cân bằng hoá học sau:
b) Cân bằng sẽ chuyển dịch theo chiều nào khi giảm nhiệt độ của hệ?
Lời giải:
a)
b) , phản ứng tỏa nhiệt cân bằng chuyển dịch theo chiều thuận khi giảm nhiệt độ của hệ.
Lời giải:
Thí nghiệm 1:
Thí nghiệm 2:
Áp dụng định luật bảo toàn điện tích: Số mol Fe2+ = 0,001 mol.
Công thức của X có dạng: (NH4)2Fe(SO4)2.nH2O = 0,001 mol.
M = 392 n = 6.
Bài 9.22 trang 37 Sách bài tập Hóa học 11: Cho phản ứng sau:
b) Năng lượng liên kết S-S trong phân tử S8(g), biết Eb(H-H) = 436 kJ/mol và Eb(S-H) = 363 kJ/mol.
Lời giải:
a)
b) 436.1 + Eb(S-S).1 – 363.2 = -33,3 Eb(S-S) = 257 kJ/mol.
Bài 9.23 trang 37 Sách bài tập Hóa học 11: Hydrogen sulfide phân huỷ theo phản ứng sau đây:
Hằng số cân bằng KC = 9,3.10-8 ở 427oC.
a) Viết biểu thức hằng số cân bằng KC của phản ứng.
c) Ở 427oC, tính hằng số cân bằng K’C của phản ứng:
Lời giải:
b)
Phản ứng thuận là phản ứng thu nhiệt.
a) Trong khí quyển, SO2 chuyển hoá thành H2SO4 trong nước mưa theo sơ đồ sau:
Viết các phương trình hoá học.
- Thể tích nước mưa đã rơi xuống khu công nghiệp.
- Khối lượng H2SO4 trong lượng nước mưa, biết nồng độ H2SO4 trong nước mưa là 2.10-5 M.
c) Lượng acid trong nước mưa có thể ăn mòn các công trình bằng đá vôi.
- Viết 1 phương trình hoá học minh hoạ.
- Khối lượng CaCO3 tối đa bị ăn mòn bởi lượng acid trên.
d) Em hãy tìm hiểu về nguyên nhân phát sinh các khí gây mưa acid và đề xuất giải pháp hạn chế.
Lời giải:
a) 2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
b) Thể tích nước mưa: V = 10.(1 000 m)2.0,08 m = 8.105 m3.
Khối lượng H2SO4 trong nước mưa:
m = 98.2.10-5.8.108 = 1 568.103 (g) = 1 568 kg.
c) CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Khối lượng đá vôi bị ăn mòn bằng:
d)
- Nguyên nhân phát sinh các khí gây mưa acid:
Nguồn phát sinh sulfur dioxide
Sulfur dioxide được sinh ra từ cả nguồn tự nhiên (khí thải núi lửa) và nguồn nhân tạo. Trên toàn thế giới, nguồn sulfur dioxide tự nhiên chiếm ưu thế, nhưng ở các khu vực đô thị và công nghiệp, nguồn nhân tạo chiếm ưu thế.
Nguồn sulfur dioxide nhân tạo chủ yếu sinh ra từ quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid,....
Nguồn gốc phát sinh NOx trong không khí
Bên cạnh nguồn gốc tự nhiên như núi lửa phun trào, cháy rừng, mưa dông kèm theo sấm sét, sự phân huỷ các hợp chất hữu cơ, thì sự phát sinh NOx chủ yếu là do hoạt động của con người. Các nguồn gây phát thải NOx nhân tạo từ hoạt động giao thông vận tải, sản xuất công nghiệp, nông nghiệp, nhà máy nhiệt điện và trong đời sống.
- Giải pháp hạn chế phát sinh NOx, SO2: tăng cưởng sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo; sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên; cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur, nitrogen …
Xem thêm lời giải bài tập SBT Hoá học lớp 11 Kết nối tri thức hay, chi tiết khác:
Bài 7: Sulfur và sulfur dioxide
Bài 8: Sulfuric acid và muối sulfate
Bài 10: Hợp chất hữu cơ và hoá học hữu cơ