Giải Sách bài tập Hóa học 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
B. 13
C. 11
D. 14
Lời giải:
Đáp án đúng là: A
Cấu hình electron của X là: 1s22s22p63s2.
Vậy số hiệu nguyên tử của X = số electron = 12.
Bài 5.2 trang 19 SBT Hóa học 10: Chu kì là
A. dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều khối lượng nguyên tử tăng dần.
B. dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số khối tăng dần.
C. dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân nguyên tử tăng dần.
D. dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số neutron tăng dần.
Lời giải:
Đáp án đúng là: C
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân nguyên tử tăng dần.
Bài 5.3 trang 19 SBT Hóa học 10: Nhóm nguyên tố là
A. tập hợp các nguyên tố mà nguyên tử có cấu hình electron giống nhau, được xếp ở cùng một cột.
B. tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hóa học giống nhau và được xếp thành một cột.
C. tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
D. tập hợp các nguyên tố mà nguyên tử có tính chất hóa học giống nhau và được xếp cùng một cột.
Lời giải:
Đáp án đúng là: C
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một cột.
D. Theo chiều tăng khối lượng nguyên tử.
Lời giải:
Đáp án đúng là: D
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
+ Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
+ Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm.
A. Lớp ngoài cùng của sulfur có 6 electron.
B. Hạt nhân nguyên tử sulfur có 16 electron.
C. Trong bảng tuần hoàn sulfur nằm ở chu kì 3.
D. Sulfur nằm ở nhóm VIA.
Lời giải:
Đáp án đúng là: B
Trong hạt nhân nguyên tử không có chứa electron.
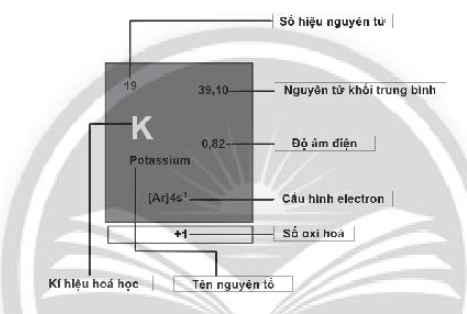
Bài 5.6 trang 20 SBT Hóa học 10: Hãy cho biết ý nghĩa của các thông tin có trong ô nguyên tố sau:
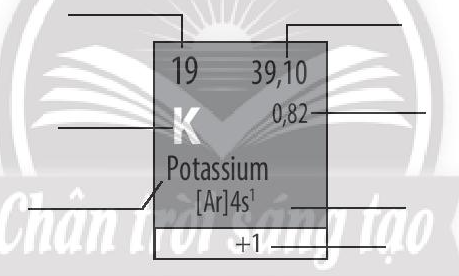 Lời giải:
Lời giải:
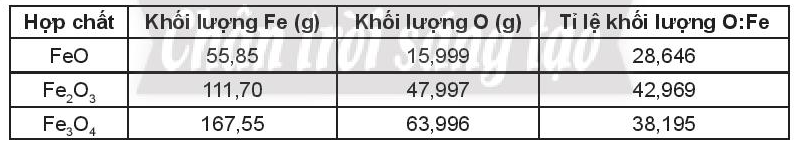
Lời giải:
Bài 5.8 trang 20 SBT Hóa học 10: Hãy giải thích vì sao chu kì 3 chỉ có 8 nguyên tố.
Lời giải:
Các nguyên tố ở chu kì 3 có 3 lớp electron. Lớp thứ 3 có 3 phân lớp là 3s, 3p và 3d. Do trật tự phân mức năng lượng là: 1s 2s 2p 3s 3p 4s 3d … nên chu kì 3 chỉ có 8 nguyên tố ứng với số electron trên lớp thứ 3 thay đổi từ 1 đến 8 hay cấu hình electron thay đổi từ 3s13p0 đến 3s23p6.
Bài 5.9 trang 21 SBT Hóa học 10: Xác định vị trí của nguyên tố (ô, chu kì và nhóm) của nguyên tố có:
a. Số hiệu nguyên tử là 20, là nguyên tố giúp xương chắc khỏe, phòng ngừa những bệnh loãng xương, giảm tình trạng đau nhức và khó khăn trong vận động, làm nhanh lành các vết nứt gãy trên xương.
b. 9 electron, được sử dụng để điều chế một số dẫn xuất hydrocarbon, làm sản phẩm trung gian để sản xuất ra chất dẻo.
c. 28 proton, được dùng trong việc chế tạo hợp kim chống ăn mòn.
d. Số khối là 52 và 28 neutron, dùng chế tạo thép không gỉ.
Lời giải:
a) Z = 20, cấu hình electron: 1s22s22p63s23p64s2
Nguyên tố này thuộc ô 20 (Z = 20); chu kì 4 (do có 4 lớp electron); nhóm IIA (do nguyên tố s, 2 electron lớp ngoài cùng).
b) Nguyên tử có 9 electron nên Z = 9, cấu hình electron: 1s22s22p5
Nguyên tố này thuộc ô 9 (Z = 9); chu kì 2 (do có 2 lớp electron); nhóm VIIA (do nguyên tố p, 7 electron lớp ngoài cùng).
c) Nguyên tử có 28 proton nên Z = 28, cấu hình electron: 1s22s22p63s23p63d84s2.
Nguyên tố này thuộc ô 28 (Z = 28), chu kì 4 (do có 4 lớp electron), nhóm VIIIB (do nguyên tố d, có tổng số electron trên 2 phân lớp 3d và 4s là 10).
d) Z = A – N = 52 – 28 = 24, cấu hình electron: 1s22s22p63s23p63d54s1
Nguyên tố này thuộc ô 24 (Z = 24), chu kì 4 (do có 4 lớp electron), nhóm VIB (do có 6 electron hóa trị).
a. Chu kì 3, nhóm IIIA được dùng trong ngành công nghiệp chế tạo, cụ thể là tạo ra các chi tiết cho xe ô tô, xe tải, tàu hỏa, tàu biển và cả máy bay.
b. Chu kì 4, nhóm IB, được sử dụng rất nhiều trong sản xuất các nguyên liệu như dây điện, que hàn, tay cầm, các đồ dùng nội thất trong nhà, các tượng đúc, nam châm điện từ, các động cơ máy móc, …
Lời giải:
a) Nguyên tố thuộc chu kì 3 nên có 3 lớp electron; thuộc nhóm IIIA nên có 3 electron lớp ngoài cùng:
Cấu hình electron: 1s22s22p63s23p1, Z = 13, nguyên tố nhôm, Al (hay aluminium).
b) Nguyên tố thuộc chu kì 4 nên có 4 lớp electron; thuộc nhóm IB nên có 1 electron hóa trị, nguyên tố d.
Cấu hình electron có thể có:
+ Trường hợp 1: 1s22s22p63s23p63d54s1, Z = 24, nguyên tố là chromine (loại).
+ Trường hợp 2: 1s22s22p63s23p63d104s1, Z = 29, nguyên tố copper (thỏa mãn).
Dựa vào các ứng dụng của nguyên tố, thấy trường hợp 2 thỏa mãn.
a. Viết cấu hình electron của X và Y
b. Xác định vị trí của X và Y trong bảng tuần hoàn và công thức phân tử hợp chất XY2.
Lời giải:
a) Gọi số hạt proton, neutron và electron của nguyên tử X là p, n, e và hạt proton, neutron và electron của nguyên tử Y là p’; n’; e’.
Theo bài ta ta có: {p=n=ep'
Một cách gần đúng ta có: Mx = 2p; MY = 2p’.
Lại có trong XY2, X chiếm 50% về khối lượng nên:
Tổng số proton trong phân tử XY2 là 32 nên: p + 2p’ = 32 (2)
Từ (1) và (2) giải hệ phương trình được: p = 16 và p’ = 8.
p = 16 nên ZX = 16, X có cấu hình electron: 1s22s22p63s23p4
p’ = 8 nên ZY = 8, Y có cấu hình electron: 1s22s22p4
b)
X ở ô thứ 16 (do Z = 16), chu kì 3 (do có 3 lớp electron), nhóm VIA (do nguyên tố p, 6 electron lớp ngoài cùng); X là sulfur (S).
Y ở ô thứ 8 (do Z = 8), chu kì 2 (do có 2 lớp electron), nhóm VIA (do nguyên tố p, 6 electron lớp ngoài cùng); Y là oxygen (O).
Công thức phân tử hợp chất XY2 là SO2.
a. Hãy viết cấu hình electron của nguyên tử X, Y.
b. Xác định vị trí của X, Y trong bảng tuần hoàn và tên nguyên tố X, Y.
Lời giải:
a) X và Y đứng kế tiếp nhau trong cùng một chu kì nên số proton của chúng chỉ khác nhau 1 đơn vị.
Giả sử ZX < ZY, ta có ZY = ZX + 1 (1)
Theo bài ra, tổng số điện tích hạt nhân của X và Y là 25 nên:
ZX + ZY = 25 (2)
Từ (1) và (2) có ZX = 12 và ZY = 13.
Cấu hình electron của X là: 1s22s22p63s2;
Cấu hình electron của Y là: 1s22s22p63s23p1.
b)
+ X ở ô thứ 12 (do Z = 12); chu kì 3 (do có 3 lớp electron); nhóm IIA (do nguyên tố s, 2 electron lớp ngoài cùng). X là magnesium (Mg).
+ Y ở ô thứ 13 (do Z = 13); chu kì 3 (do có 3 lớp electron); nhóm IIIA (do nguyên tố p, 3 electron ở lớp ngoài cùng). Y là aluminium (Al).
Lời giải:
Gọi ZX, ZY lần lượt là số proton của nguyên tử nguyên tố X và Y. Ta có:
ZX + ZY = 32 (1)
Vì X và Y thuộc cùng nhóm A ở hai chu kì kế tiếp nhau nên số proton của chúng khác nhau 8, 18 hoặc 32 đơn vị.
Giả sử ZY > ZX.
Trường hợp 1: ZY – ZX = 8 (2)
Kết hợp (1) và (2) giải hệ phương trình ta được: ZX = 12; ZY = 20.
Cấu hình electron của X: 1s22s22p63s2 (nhóm IIA).
Cấu hình electron của Y: 1s22s22p63s23p64s2 (nhóm IIA).
Vậy trường hợp 1 thỏa mãn, X là magnesium (Mg) và Y là calcium (Ca).
Trường hợp 2: ZY – ZX = 18 (3)
Kết hợp (1) và (3) giải hệ phương trình ta được: ZX = 7; ZY = 25.
Cấu hình electron của X: 1s22s22p3 (nhóm VA)
Cấu hình electron của Y: 1s22s22p63s23p63d54s2 (nhóm VIIB)
Vậy trường hợp 2 không thỏa mãn.
Trường hợp 3: ZY – ZX = 32 (4)
Kết hợp (1) và (4) giải hệ phương trình ta được: ZX = 0; ZY = 32.
Vậy trường hợp 3 không thỏa mãn.
Lời giải:
Gọi số proton của X và Y lần lượt là ZX và ZY. Do X đứng sau Y trong bảng tuần hoàn nên ZX > ZY.
Tổng số proton trong hạt nhân nguyên tử của X và Y là 23 nên: ZX + ZY = 23 (1).
X và Y là 2 nguyên tố thuộc 2 nhóm kế tiếp trong bảng tuần hoàn nên số proton của X và Y hơn kém nhau 1 hoặc 7 hoặc 9.
Trường hợp 1: ZX – ZY = 1 (2)
Kết hợp (1) và (2) được ZX = 12 và ZY = 11. X là Mg (magnesium) và Y là Na (sodium).
Ở trạng thái đơn chất, hai nguyên tố này không phản ứng được với nhau (loại).
Trường hợp 2: ZX – ZY = 7 (3)
Kết hợp (1) và (3) được ZX = 15 và ZY = 8. X là P (phosphorus) và Y là O (oxygen).
Ở trạng thái đơn chất, hai nguyên tố này phản ứng được với nhau (nhận).
Trường hợp 3: ZX – ZY = 9 (4)
Kết hợp (1) và (4) được ZX = 16 và ZY = 7. X là S (sulfur) và Y là N (nitrogen).
Ở trạng thái đơn chất, hai nguyên tố này không phản ứng được với nhau (loại).
Vậy X là P (phosphorus) và Y là O (oxygen).
Lời giải:
Kết tủa là AgCl;
Phương trình hóa học:
Do hai kim loại kiềm ở hai chu kì kế tiếp nhau, nên 2 kim loại là lithium (M = 7) và sodium (M = 23).
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học




