Giải Sách bài tập Hóa học 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
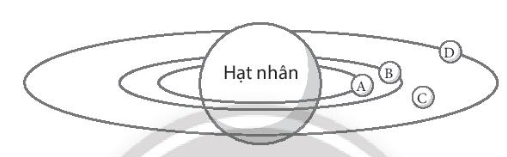 A. Vị trí A
A. Vị trí A
B. Vị trí B
C. Vị trí C
D. Vị trí D
Lời giải:
Đáp án đúng là: C
Theo mô hình nguyên tử Rutherford – Bohr các electron được sắp xếp vào từng lớp do đó tại vị trí C electron không xuất hiện.
Bài 4.2 trang 14 SBT Hóa học 10: Lớp electron thứ 3 có bao nhiêu phân lớp?
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: C
Lớp thứ n có n phân lớp (với n ≤ 4).
Vậy lớp thứ 3 có 3 phân lớp.
Bài 4.3 trang 14 SBT Hóa học 10: Phát biểu nào sau đây đúng?
A. Số phân lớp electron có trong lớp N là 4.
B. Số phân lớp electron có trong lớp M là 4.
C. Số orbital có trong lớp N là 9.
D. Số orbital có trong lớp M là 8.
Lời giải:
Đáp án đúng là: A
Lớp N (n = 4) có 4 phân lớp: 4s; 4p; 4d; 4f. ⇒ A đúng
Lớp M (n = 3) có 3 phân lớp: 3s, 3p, 3d ⇒ B sai.
Số orbital trong lớp thứ n bằng n2 (với n ≤ 4).
⇒ Lớp thứ 4 (lớp N) có 42 = 16 orbital ⇒ C sai
Lớp thứ 3 (lớp M) có 32 = 9 orbital ⇒ D sai.
Bài 4.4 trang 14 SBT Hóa học 10: Phát biểu nào sau đây đúng?
A. Lớp K là lớp xa hạt nhân nhất.
B. Các electron trong cùng một lớp có mức năng lượng bằng nhau.
C. Các electron trên cùng phân lớp có mức năng lượng bằng nhau.
D. Lớp N có 4 orbital.
Lời giải:
Đáp án đúng là: C
Các electron trên cùng phân lớp có mức năng lượng bằng nhau.
A sai vì lớp K gần hạt nhân nhất.
B sai vì các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
D sai vì lớp N (n = 4) có n2 = 42 = 16 AO.
A. Có cùng sự định hướng không gian.
B. Có cùng mức năng lượng
C. Khác nhau về mức năng lượng
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Lời giải:
Đáp án đúng là: B
Các orbital trong một phân lớp electron có cùng mức năng lượng.
Bài 4.6 trang 15 SBT Hóa học 10: Phát biểu nào sau đây không đúng?
B. Lớp L có 4 orbital.
C. Phân lớp p có 3 orbital.
D. Năng lượng của electron trên lớp K là thấp nhất.
Lời giải:
Đáp án đúng là: A
Phát biểu A sai do lớp M (n = 3) có 3 phân lớp 3s; 3p; 3d.
Bài 4.7 trang 15 SBT Hóa học 10: Cấu hình electron nào sau đây viết sai?
A. 1s22s22p5
B. 1s22s22p63s23p64s1
C. 1s22s22p63s23p64s1
D. 1s22s22p63s23p63d34s2
Lời giải:
Đáp án đúng là: C
Cấu hình electron 1s22s22p63s23p64s24p5 viết sai do thiếu phân lớp 3d.
A. 24.
B. 25.
C. 27.
D. 29.
Lời giải:
Đáp án đúng là: C
Cấu hình electron nguyên tử cobalt: 1s22s22p63s23p63d74s2.
Vậy cobalt có 27 electron, số hiệu nguyên tử là 27.
Bài 4.9 trang 15 SBT Hóa học 10: Nguyên tử Fe có kí hiệu F5626e. Cho các phát biểu sau về Fe:
(1) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố Fe có 30 neutron trong hạt nhân
(3) Fe là một phi kim
(4) Fe là nguyên tố d
Trong các phát biểu trên, phát biểu đúng là
A. (1), (2), (3) và (4)
B. (1), (2), và (4)
C. (2) và (4)
D. (2), (3) và (4)
Lời giải:
Đáp án đúng là: C
Cấu hình electron nguyên tử Fe: [Ar]3d64s2
Vậy Fe có 2 electron lớp ngoài cùng → (1) sai.
Fe có số neutron = 56 – 26 = 30 → (2) đúng.
Fe là kim loại → (3) sai.
Fe là nguyên tố d → (4) đúng.
A. X ở ô số 15 trong bảng tuần hoàn
B. X là một phi kim
C. Nguyên tử của nguyên tố X có 9 electron p
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Lời giải:
Đáp án đúng là: D
Phát biểu D sai vì X có 5 phân lớp: 1s; 2s; 2p; 3s; 3p.
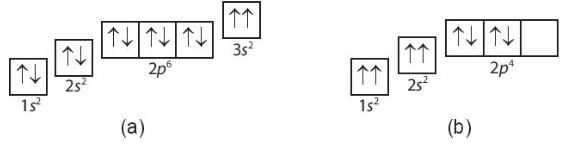
Lời giải:
Trường hợp (a) không tuân theo nguyên lí Pauli vì có 2 electron cùng chiều quay trong AO 3s.
Trường hợp (b) không tuân theo nguyên lí Pauli vì có 2 electron cùng chiều quay trong các AO 1s, 2s. Ngoài ra, trường hợp (b) cũng không tuân theo quy tắc Hund vì electron phân bố trên phân lớp 2p chưa đạt được số electron độc thân nhiều nhất.
Lời giải:
Lời giải:
A. khí hiếm và kim loại
B. kim loại và khí hiếm
C. kim loại và kim loại
D. phi kim và kim loại
Lời giải:
Đáp án đúng là: D
- Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s nên cấu hình electron nguyên tử Y là: 1s22s22p63s23p64s1.
Y là kim loại do có 1 electron ở lớp ngoài cùng.
- Nguyên tử X và Y có số electron hơn kém nhau là 3 nên số electron của X là:
19 – 3 = 16.
Cấu hình electron của X: 1s22s22p63s23p4. X là phi kim do có 6 electron ở lớp ngoài cùng.
Lời giải:
X có 3 lớp electron, lớp 1 có 2 electron, lớp 2 có 8 electron, lớp 3 có 4 electron.
Số hiệu nguyên tử X là 2 + 8 + 4 = 14. Vậy X là Si (Silicon).
Cấu hình electron của X là: 1s22s22p63s23p2 hay [Ne] 3s23p2.
Lời giải:
- Nguyên tử nguyên tố X có tổng các electron trong các phân lớp p là 7, nên cấu hình electron nguyên tử X là: 1s22s22p63s23p1 ⇒ ZX = 13, X là Al (Aluminium).
- Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt nên: 2ZY – 2ZX = 8 ⇒ ZY = ZX + 4 = 17, Y là Cl (Chlorine).
Lời giải:
Nguyên tố có phân lớp d, có 4 lớp electron nên electron cuối cùng trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63dx4s2.
Vậy tổng số electron s và electron p của nguyên tố là: 2 + 2 + 6 + 2 + 6 + 2 = 20.
Bài 4.18* trang 16 SBT Hóa học 10: A được dùng để chế tạo đèn có cường độ sáng cao. Nguyên tử A có electron ở phân lớp 3d chỉ bằng một nửa phân lớp 4s. Viết cấu hình electron của nguyên tử A và tên nguyên tố A.
Lời giải:
Nguyên tử A có electron ở phân lớp 3d nên phân lớp 4s của A đã bão hòa (với 2 electron). Vậy số electron trên phân lớp 3d của A là 1.
Cấu hình electron nguyên tử A: 1s22s22p63s23p63d14s2.
Lời giải:
- Nguyên tố B có phân lớp cuối là 3p5 nên có cấu hình electron: 1s22s22p63s23p5.
⇒ ZB = 17, B là chlorine (Cl).
- Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1 nên có 3 trường hợp có thể xảy ra:
+ Trường hợp 1: Nguyên tử A không có electron ở 3d. Cấu hình electron của A là: 1s22s22p63s23p64s1 ⇒ ZA = 19, A là potassium (K).
+ Trường hợp 2: Nguyên tử A có phân lớp 3d nửa bão hòa. Cấu hình electron của A là: 1s22s22p63s23p63d54s1 ⇒ ZA = 24, A là chromium (Cr).
+ Trường hợp 3: Nguyên tử A có phân lớp 3d bão hòa. Cấu hình electron của A là: 1s22s22p63s23p63d104s1 ⇒ ZA = 29, A là copper (Cu).
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 2: Thành phần của nguyên tử




