Giải Sách bài tập Hóa học 10 Bài 5: Lớp, phân lớp và cấu hình electron
Bài 5.1 trang 12 SBT Hóa học 10: Phát biểu nào sau đây là đúng?
A. Electron trong cùng một lớp có năng lượng bằng nhau.
B. Electron trong cùng một phân lớp có năng lượng bằng nhau.
C. Electron ở các phân lớp 1s; 2s; 3s có năng lượng bằng nhau.
D. Electron ở lớp bên ngoài có năng lượng thấp hơn electron ở lớp bên trong.
Lời giải:
Đáp án đúng là: B
Electron trong cùng một phân lớp có năng lượng bằng nhau.
A sai vì: Electron trong cùng một lớp có năng lượng gần bằng nhau.
C sai vì: Electron ở các phân lớp 1s; 2s; 3s có năng lượng khác nhau.
D sai vì: Electron ở lớp bên ngoài có năng lượng cao hơn electron ở lớp bên trong.
Bài 5.2 trang 13 SBT Hóa học 10: Phát biểu nào sau đây không đúng?
A. Electron càng ở xa hạt nhân thì có năng lượng càng thấp.
B. Số lượng electron tối đa trong một phân lớp luôn là một số chẵn.
C. Phân lớp p có nhiều orbital hơn phân lớp s.
D. Số electron tối đa trên phân lớp p gấp ba lần số electron tối đa trên phân lớp s.
Lời giải:
Đáp án đúng là: A
Phát biểu A không đúng vì: Electron càng ở xa hạt nhân thì có năng lượng càng cao.
Bài 5.3 trang 13 SBT Hóa học 10: Mỗi phát biểu sau đây là đúng hay sai?
(1) Số lượng orbital trong các phân lớp 1s, 2s, 3s là bằng nhau.
(2) Số lượng orbital trong các phân lớp 3s, 3p, 3d là bằng nhau.
(3) Các electron trên các phân lớp 1s, 2s, 3s có năng lượng bằng nhau.
(4) Các electron trên các phân lớp 3s, 3p, 3d có năng lượng bằng nhau.
(5) Số lượng electron tối đa trong một lớp là 2n2.
(6) Số lượng các orbital trong một phân lớp (s, p, d, f) luôn là một số lẻ.
Lời giải:
Các phát biểu (1); (5); (6) đúng.
Phát biểu (2) sai vì: Số lượng orbital trong các phân lớp 3s, 3p, 3d là khác nhau.
Phát biểu (3) sai vì: Các electron trên các phân lớp 1s, 2s, 3s có năng lượng khác nhau.
Phát biểu (4) sai vì: Các electron trên các phân lớp 3s, 3p, 3d có năng lượng gần bằng nhau.
Bài 5.4 trang 13 SBT Hóa học 10: Điền từ/ cụm từ hoặc số thích hợp vào chỗ trống trong mỗi phát biểu sau:
a) Các electron trong lớp vỏ nguyên tử được phân bố vào các ...(1)... và ...(2)... dựa theo năng lượng của chúng. Các electron thuộc cùng một lớp có năng lượng ...(3)..., các electron thuộc cùng một phân lớp có năng lượng ...(4).... Các electron ở ...(5)... có vai trò quyết định đến tính chất hoá học đặc trưng của nguyên tố.
b) Magnesium được sử dụng nhiều trong công nghiệp để chế tạo các bộ phận của máy bay, ô tô. Nguyên tử magnesium có 12 electron, được phân bố vào ...(1)... lớp. Lớp ngoài cùng của magnesium có ...(2)... electron.
Lời giải:
a) Các electron trong lớp vỏ nguyên tử được phân bố vào các (1) lớp và (2) phân lớp dựa theo năng lượng của chúng. Các electron thuộc cùng một lớp có năng lượng (3) gần bằng nhau, các electron thuộc cùng một phân lớp có năng lượng (4) bằng nhau. Các electron ở (5) lớp ngoài cùng có vai trò quyết định đến tính chất hoá học đặc trưng của nguyên tố.
b) Magnesium được sử dụng nhiều trong công nghiệp để chế tạo các bộ phận của máy bay, ô tô. Nguyên tử magnesium có 12 electron, được phân bố vào (1) ba lớp. Lớp ngoài cùng của magnesium có (2) hai electron.
Bài 5.5 trang 13 SBT Hóa học 10: Số phân lớp bão hòa trong các phân lớp: 1s2; 2s2; 2p3; 3d10; 3p4 là
A. 1.
B. 2.
C. 3.
D. 5.
Lời giải:
Đáp án đúng là: C
Phân lớp bão hòa là phân lớp đã chứa tối đa electron.
Các phân lớp bão hòa là: 1s2; 2s2; 3d10.
|
Cột A |
Cột B |
|
a) |
1. Phân lớp bão hòa |
|
b) |
2. Phân lớp bán (nửa) bão hòa |
|
c) |
3. Phân lớp chứa các AO trống |
Lời giải:
- Phân lớp bão hòa đã có tối đa electron.
- Phân lớp bán bão hòa chứa một nửa số electron tối đa.
- AO trống là AO không chứa electron nào.
Vậy a ghép với 3; b ghép với 2; c ghép với 1.
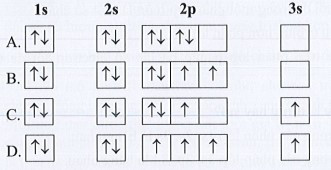
Lời giải:
Đáp án đúng là: B
Cách biểu diễn cấu hình electron theo orbital:
- Viết cấu hình electron của nguyên tử.
- Biểu diễn mỗi AO bằng một ô vuông, các AO trong cùng một phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
- Điền electron vào từng ô AO theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng 1 mũi tên.
+ Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất.
+ Electron được điền vào các ô orbital theo thứ tự từ trái sang phải.
+ Trong một ô AO, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
Sự sắp xếp electron trong nguyên tử O theo orbital là:
![]()
A. 1s22s22p6; 1s22s22p63s1 và 1s22s22p5.
B. đều có cấu hình 1s22s22p6.
C. 1s22s22p6; 1s22s22p5 và 1s22s22p4.
D. 1s22s22p6; 1s22s22p5; 1s22s22p3.
Lời giải:
Đáp án đúng là: B
- Ne (Z = 10) có cấu hình electron: 1s22s22p6.
- Na (Z = 11) có cấu hình electron: 1s22s22p63s1
Na nhường 1 electron để tạo thành ion Na+.
Cấu hình electron của Na+ là: 1s22s22p6.
- F (Z = 9) có cấu hình electron: 1s22s22p5
F nhận 1 electron để tạo thành ion F-.
Cấu hình electron của F- là: 1s22s22p6.
|
Cột A |
Cột B |
|
a) 1s22s2 b) 1s22s22p4 c) 1s22s22p5 d) 1s22s22p6 |
1. O 2. C2+ 3. N3- 4. F 5. C2- |
Lời giải:
a ghép với 2; b ghép với 1; c ghép với 4; d ghép với 3.
Giải thích:
1. O (Z = 8) có cấu hình electron 1s22s22p4.
2. C (Z = 6) có cấu hình electron 1s22s22p2
C nhường 2 electron được ion C2+ có cấu hình electron: 1s22s2.
3. N (Z = 7) có cấu hình electron 1s22s22p3
N nhận 3 electron được ion N3- có cấu hình electron 1s22s22p6.
4. F (Z = 9) có cấu hình electron: 1s22s22p5.
A. N.
B. O.
C. F.
D. Ne.
Lời giải:
Đáp án đúng là: A
Cấu hình electron N theo orbital:
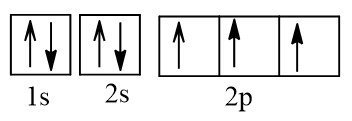
Cấu hình electron O theo orbital:
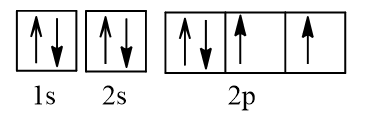
Cấu hình electron F theo orbital:
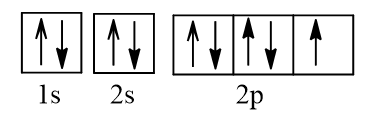
Cấu hình electron Ne theo orbital:
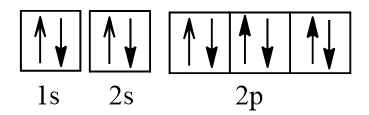
Vậy nguyên tử N có nhiều electron độc thân nhất (3 electron độc thân).
|
Cột A |
Cột B |
|
a) 1s22s22p6 b) 1s22s22p5 c) 1s22s22p63s1 d) 1s22s22p63s23p3 |
1. Kim loại 2. Phi kim 3. Khí hiếm |
Lời giải:
a ghép với 3; b và d ghép với 2; c ghép với 1.
Giải thích:
a) 1s22s22p6: Nguyên tử có 8 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố khí hiếm.
b) 1s22s22p5: Nguyên tử có 7 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố phi kim.
c) 1s22s22p63s1: Nguyên tử có 1 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
d) 1s22s22p63s23p3: Nguyên tử có 5 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố phi kim.
Số electron hóa trị và tính chất đặc trưng của nguyên tố hóa học này là
A. 3, tính kim loại.
B. 5, tính phi kim.
C. 7, tính phi kim.
D. 4, tính kim loại.
Lời giải:
Đáp án đúng là: B
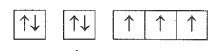
Dựa vào cấu hình electron theo orbital ta có cấu hình electron nguyên tử như sau:
1s22s22p3.
Vậy nguyên tử có 5 electron hóa trị, là phi kim (do có 5 electron ở lớp ngoài cùng).
Bài 5.13 trang 15 SBT Hóa học 10: Cho các cấu hình electron của một số nguyên tử nguyên tố như sau:
(1) 1s22s22p6
(2) 1s22s22p63s2
(3) 1s22s22p63s23p63d64s2
(4) 1s22s22p63s23p63d14s2
(5) 1s22s22p63s23p4
(6) 1s22s22p63s23p5
Số lượng các nguyên tố kim loại trong số các nguyên tố ở trên là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: C
Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng thường là nguyên tử của nguyên tố kim loại.
Các nguyên tố kim loại là:
(2) 1s22s22p63s2
(3) 1s22s22p63s23p63d64s2
(4) 1s22s22p63s23p63d14s2
a) Oxygen là nguyên tố chiếm tỉ lệ phần trăm khối lượng cao nhất trong cơ thể con người (khoảng 65%). Hãy viết cấu hình electron của O và O2- (Z = 8). Cho biết để hình thành ion O2-, nguyên tử O sẽ nhận thêm electron vào orbital nào. Xác định số electron độc thân trong nguyên tử và ion này.
b) Nhôm (aluminium) được sử dụng phổ biến trong đời sống (chế tạo dụng cụ nhà bếp, cửa, …) cũng như công nghiệp (chế tạo một số bộ phận của máy bay). Hãy biểu diễn cấu hình electron của Al và ion Al3+ (Z = 13) dưới dạng ô orbital. Cho biết để tạo thành ion Al3+, nguyên tử Al sẽ mất đi electron từ orbital nào. Xác định số electron độc thân trong các nguyên tử và ion này.
Lời giải:
a) Nguyên tử O (Z = 8) có cấu hình electron: 1s22s22p4
Biểu diễn dưới dạng ô AO:
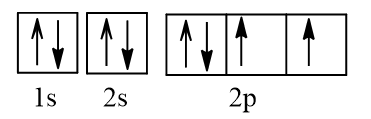
Vậy nguyên tử O có 2 electron độc thân.
O nhận 2 electron vào AO 2p hình thành nên ion O2- có cấu hình electron:
1s22s22p6.
Biểu diễn dưới dạng ô AO:
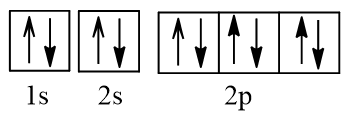
Ion O2- không có electron độc thân nào.
b) Nguyên tử Al (Z = 13) có cấu hình electron: 1s22s22p63s23p1.
Biểu diễn dưới dạng ô orbital:
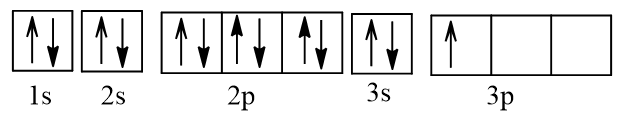
Vậy Al có 1 electron độc thân.
Nguyên tử Al nhường đi 3 electron từ các orbital 3p, 3s để tạo thành ion Al3+ có cấu hình electron: 1s22s22p6.
Biểu diễn dưới dạng ô orbital:
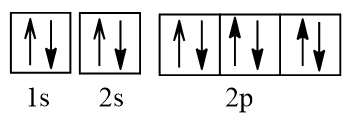
Vậy ion Al3+ không có electron độc thân nào.
Lời giải:
Số lượng electron trong cấu hình 1s22s22p6 là 10 electron.
- Nếu đây là cấu hình electron của nguyên tử thì nguyên tử phải có 10 electron, do đó Z = 10, đó là nguyên tử Ne.
- Nếu đây là cấu hình electron của cation Mn+ (n = 1, 2) thì cation này được tạo ra từ nguyên tử M bằng cách tách đi n electron:
M → Mn+ (10 electron) + ne
Vậy số electron trong nguyên tử M là: 10 + n.
+ Nếu n = 1, M có 11 electron nên Z = 11 ⇒ ion Na+ có cấu hình electron: 1s22s22p6.
+ Nếu n = 2, M có 12 electron nên Z = 12 ⇒ ion Mg2+ có cấu hình electron: 1s22s22p6.
- Nếu đây là ion Xn- (n = 1, 2) thì anion này được tạo ra từ X bằng cách nhận vào n electron.
Vậy số electron trong nguyên tử X là: 10 – n.
+ Nếu n = 1, X có 9 electron nên Z = 9 ⇒ ion F- có cấu hình electron: 1s22s22p6.
+ Nếu n = 2, X có 8 electron nên Z = 8 ⇒ ion O2- có cấu hình electron: 1s22s22p6.
Lời giải:
Co có Z = 27 nên có cấu hình electron là: 1s22s22p63s23p63d74s2.
Khi Co mất đi 2 electron và 3 electron sẽ lần lượt tạo ra: Co2+ và Co3+. Các electron sẽ tách đi từ các lớp ngoài rồi tới lớp trong. Cấu hình electron của hai ion này là:
Co2+: 1s22s22p63s23p63d7
Co3+: 1s22s22p63s23p63d6
Sơ đồ phân bố electron vào các ô orbital:
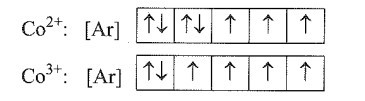
Số electron độc thân trong Co2+ và Co3+ lần lượt là 3 và 4.
Lời giải:
- Cấu hình electron của bromine (Z = 35): [Ar]3d104s24p5.
Nguyên tử bromine có 7 electron ở lớp ngoài cùng là phi kim điển hình.
- Cấu hình electron của krypton (Z = 36): [Ar]3d104s24p6.
Nguyên tử krypton có 8 electron ở lớp ngoài cùng nên là khí hiếm.
Lời giải:
- Cấu hình electron của Cu (Z = 29): 1s22s22p63s23p63d104s1.
Viết gọn: [Ar]3d104s1.
Biểu diễn dưới dạng ô orbital nguyên tử:
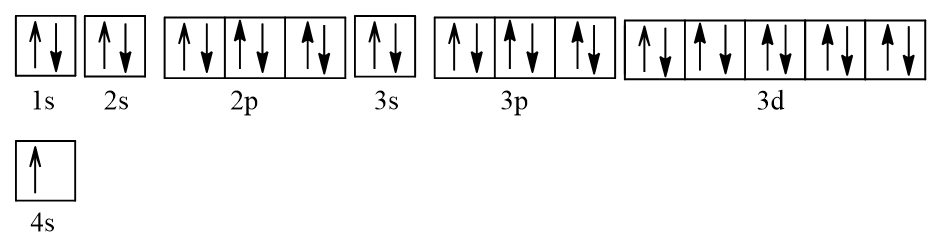
Như vậy Cu có 1 electron độc thân nên thuận từ.
- Cu nhường đi 1 electron tạo thành ion Cu+ có cấu hình electron: 1s22s22p63s23p63d10.
Viết gọn: [Ar]3d10.
Biểu diễn dưới dạng ô orbital nguyên tử:
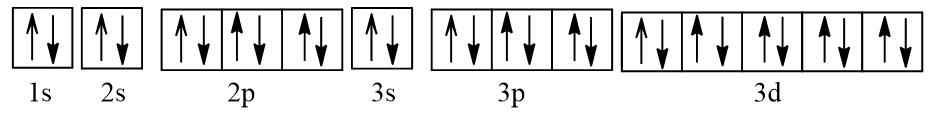
Như vậy Cu+ không có electron độc thân nên nghịch từ.
Xem thêm lời giải sách bài tập Hóa học lớp 10 Cánh diều với cuộc sống hay, chi tiết khác:
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học




