Giải Sách bài tập Hóa học 10 Bài 3: Nguyên tố hóa học
A. tính chất hóa học.
B. khối lượng nguyên tử.
C. số proton.
D. số electron.
Lời giải:
Đáp án đúng là: B
Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, nhưng khác nhau về khối lượng nguyên tử.
A. H11.
B. H21.
C. H31.
D. Không thể xác định được.
Lời giải:
Đáp án đúng là: A
Gọi x, y, z lần lượt là % số nguyên tử của mỗi đồng vị H11; H21; H31. Ta có công thức tính nguyên tử khối trung bình: ˉA=1x+2y+3zx+y+z
Do nguyên tử khối trung bình của hydrogen bằng 1,008 ≈ 1 nên đồng vị H11chiếm tỉ lệ phần trăm số nguyên tử nhiều nhất trong tự nhiên.
|
Cột A |
Cột B |
|
a) Một đồng vị đồng có 34 neutron. |
1.Cu6529 |
|
b) Một đồng vị đồng có 36 neutron. |
2.Cu6329 |
|
c) Một đồng vị potassium có 21 neutron. |
3.Ar4018 |
|
d) Một đồng vị argon có 22 neutron. |
4.K4019 |
|
|
5.K4018 |
Lời giải:
a – 2; b – 1; c – 4; d – 3
Giải thích:
1.Cu6529 có số neutron bằng: 65 – 29 = 36.
2.Cu6329 có số neutron bằng: 63 – 29 = 34.
3.Ar4018 có số neutron bằng: 40 – 18 = 22.
4.K4019 có số neutron bằng: 40 – 19 = 21.
5.K4018 là kí hiệu hóa học sai vì K có số proton là 19.
Bài 3.4 trang 8 SBT Hóa học 10: Cặp nguyên tử nào sau đây có cùng số neutron?
A. B115 và C126
B. Li73 và Be94
C. Mg2412 và Si2814
D. N147 và O168
Lời giải:
Đáp án đúng là: A
B115 và C126 có cùng số neutron là 6.
B. H3O+.
C. OD-.
D. OH-.
Lời giải:
Đáp án đúng là: D
|
|
Số electron |
Số proton |
Số neutron |
|
D- |
1 + 1 = 2 |
1 |
1 |
|
H3O+ |
3 × 1 + 8 – 1 = 10 |
3 × 1 + 8 = 11 |
3 × 0 + 8 = 8 |
|
OD- |
8 + 1 + 1 = 10 |
8 + 1 = 9 |
8 + 1 = 9 |
|
OH- |
8 + 1 + 1 = 10 |
8 + 1 = 9 |
8 + 0 = 8 |
A. 6,07.
B. 6,50.
C. 6,90.
D. 6,93.
Lời giải:
Đáp án đúng là: D
Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là:
ˉALi=6×7,42+7×92,587,42+92,58≈6,93
|
Số khối |
A |
21 |
22 |
|
Tỉ lệ (%) |
90,9 |
0,3 |
8,8 |
Biết rằng nguyên tử khối trung bình của Ne là 20,18. Giá trị số khối A của đồng vị đầu tiên là
A. 19,00.
B. 20,00.
C. 20,01.
D. Không xác định được.
Lời giải:
Đáp án đúng là: B
Áp dụng công thức tính nguyên tử khối trung bình có:
ˉA=90,9×A+0,3×21+8,8×2290,9+0,3+8,8=20,18⇒A=20
A. 6.
B. 9.
C. 12.
D. Vô số.
Lời giải:
Đáp án đúng là: C
Các loại phân tử CO2 có thể tạo ra từ các đồng vị này là:
16O 12C 16O; 16O 12C 17O; 16O 12C 18O; 17O 12C 18O; 18O 12C 18O; 17O 12C 17O;
16O 13C 16O; 16O 13C 17O; 16O 13C 18O; 17O 13C 18O; 18O 13C 18O; 17O 13C 17O;
Số lượng đồng vị bền và nguyên tử khối trung bình của zirconium là
A. 5 đồng vị, nguyên tử khối trung bình bằng 92,60.
B. 5 đồng vị, nguyên tử khối trung bình bằng 91,32.
C. 4 đồng vị, nguyên tử khối trung bình bằng 91,18.
D. 4 đồng vị, nguyên tử khối trung bình bằng 92,00.
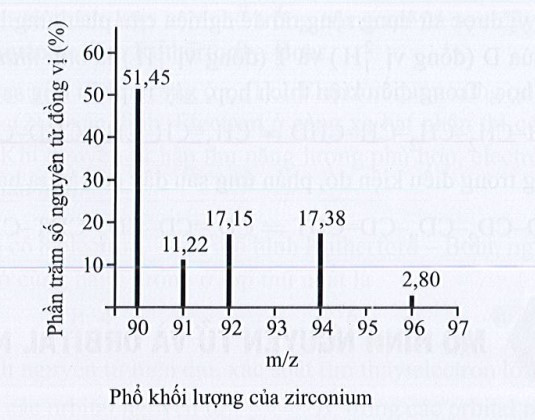
Lời giải:
Đáp án đúng là: B
Quan sát phổ khối lượng của zirconium xác định được nguyên tố này có 5 đồng vị.
Nguyên tử khối trung bình của zirconium:
ˉA=90×51,45+91×11,22+92×17,15+94×17,38+96×2,851,45+11,22+17,15+17,38+2,8=91,32
Lời giải:
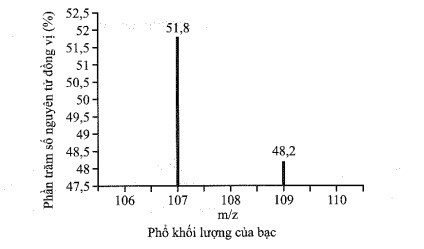
Nguyên tử khối trung bình của Ag là:
ˉA=51,8×107+48,2×10951,8+48,2=107,964
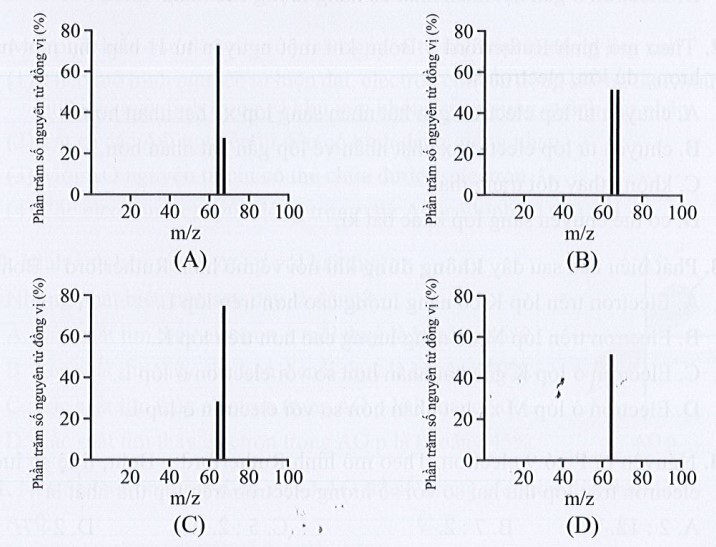
Lời giải:
Đáp án đúng là: A
Gọi % số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là x và y (%).
Theo bài ra, ta có hệ phương trình:
{x+y=10063x+65y=63,55⇔{x=72,5y=27,5
Hình vẽ phổ khối đúng là: A
CH2 = CH – CH2 – CH2 – CH = CHD ⇌ CH2 = CH – CH2 – CHD – CH = CH2 (1)
Vậy cũng trong điều kiện đó, phản ứng sau đây có xảy ra không?
CD2 = CD – CD2 – CD2 – CD = CDT ⇌ CD2 = CD – CD2 – CDT – CD = CD2 (2)
Lời giải:
Phản ứng (2) có xảy ra bởi vì phản ứng (1) xảy ra; vai trò của D và T là như nhau.
Xem thêm lời giải sách bài tập Hóa học lớp 10 Cánh diều với cuộc sống hay, chi tiết khác:
Bài 2: Thành phần của nguyên tử
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử




