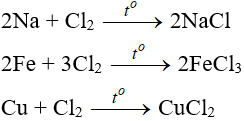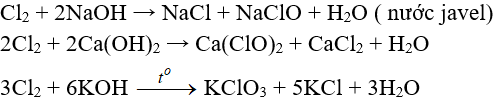Phương trình FeCl2 + Cl2 → FeCl3
1. Phương trình phản ứng hóa học
2FeCl2 + Cl2 → 2FeCl3
2. Điều kiện phản ứng
- Nhiệt độ thường
3. Cách thực hiện phản ứng
- Sục khí Cl2 vào dung dịch muối FeCl2 mới điều chế.
4. Hiện tượng nhận biết phản ứng.
- Khí màu vàng clo (Cl2) tan dần trong dung dịch Sắt II clorua (FeCl2) màu xanh lam nhạt và chuyển thành màu nâu đỏ của dung dịch Sắt III clorua (FeCl3).
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của FeCl2 (Sắt (II) clorua)
- Trong phản ứng trên FeCl2 là chất khử.
- FeCl2 thể hiện tính khử khá mạnh khi tác dụng với các chất oxi hoá mạnh như clo.
5.2. Bản chất của Cl2 (Clo)
- Trong phản ứng trên Cl2 là chất oxi hoá.
- Cl2 có khả năng tác dụng với các muối halogen khác.
6. Mở rộng tính chất hóa học của FeCl2 và Cl2
6.1. Tính chất hóa học của FeCl2
Sắt(II) clorua là tên gọi để chỉ một hợp chất được tạo bởi sắt và 2 nguyên ử clo. Thường thu được ở dạng chất rắn khan. Công thức phân tử: FeCl2
- Mang đầy đủ tính chất hóa học của muối.
Có tính khử Fe2+ → Fe3+ + 1e
Tác dụng với dung dịch kiềm:
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Tác dụng với muối
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl
- Tính khử:
Thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh:
2FeCl2 + Cl2 → 2FeCl3
Mở rộng về: Điều chế FeCl2
- Cho kim loại Fe tác dụng với axit HCl:
Fe + 2HCl → FeCl2+ H2
- Cho sắt (II) oxit tác dụng với HCl
FeO + 2HCl → FeCl2 + H2O
6.2. Tính chất hóa học của Cl2
a. Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
b. Tác dụng với phim kim
(cần có nhiệt độ hoặc có ánh sáng)
c. Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
c.1. Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
c.2. Tác dụng với dung dịch bazơ
d. Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
e. Tác dụng với chất khử khác
f. Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
7. Bạn có biết
- Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này.
8. Bài tập liên quan (có đáp án)
Câu 1. Dẫn khí clo đi vào dung dịch FeCl2, nhận thấy dung dịch từ màu lục nhạt chuyển sang màu nâu. Phản ứng này thuộc loại:
A. Phản ứng thế
B. Phản ứng phân hủy
C. Phản ứng trung hòa
D. Phản ứng oxi hóa – khử
Lời giải:
Dẫn khí Cl2 qua dung dịch FeCl2 xảy ra phản ứng: 2FeCl2 + Cl2 → 2FeCl3.
Đây là phản ứng oxi hóa khử, trong đó chất khử là FeCl2- chất oxi hóa là Cl2.
Câu 2. Trường hợp nào sau đây không xảy ra phản ứng hóa học?
A. Sục khí Cl2 vào dung dịch FeCl2.
B. Sục khí H2S vào dung dịch CuCl2.
C. Sục khí H2S vào dung dịch FeCl2.
D. Cho Fe vào dung dịch H2SO4 loãng, nguội.
Lời giải:
A. Cl2 + FeCl2 → FeCl3
B. H2S + CuCl2 → CuS + HCl
C. Không phản ứng
D. Fe + H2SO4 → FeSO4 + H2
Câu 3. Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng
A. Quỳ tím
B. Dung dịch Ba(NO3)2
C. Dung dịch AgNO3
D. Dung dịch NaOH
Lời giải:
Có thể nhận biết một số cation trên dựa vào màu sắc đặc trưng của chúng
Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch muối CuCl2, FeCl3, MgCl2 ta dùng dung dịch NaOH vì tạo các kết tủa có màu khác nhau:
Dung dịch CuCl2 tạo kết tủa xanh: CuCl2 + 2NaOH → Cu(OH)2↓xanh + 2NaCl
Dung dịch FeCl3 tạo kết tủa đỏ nâu: FeCl3 + 3NaOH → Fe(OH)3 ↓đỏ nâu + 3NaCl
Dung dịch MgCl2 tạo kết tủa trắng: MgCl2 + 2NaOH → Mg(OH)2 ↓trắng + 3NaCl
Câu 4. Phản ứng nào sau đây tạo ra sản phẩm là muối sắt (II) sunfua
A. Sắt (II)clorua tác dụng với dung dịch hidrosunfua.
B. Sắt tác dụng với dung dịch natrisunfua.
C. Sắt tác dụng với đồng sunfua nung nóng.
D. Sắt tác dụng với bột lưu huỳnh nung nóng.
Lời giải:
Fe không phản ứng với Na2S; CuS
FeCl2 không phản ứng với H2S
Câu 5. Hòa tan hoàn toàn hỗn hợp Mg và Fe trong dung dịch HCl 2M thu được khí H2 (đktc) và dung dịch D. Để kết tủa hoàn toàn các ion trong D cần 150 ml dung dịch NaOH 2M. Thể tích dung dịch HCl đã dùng là :
A. 0,1 lít.
B. 0,12 lít.
C. 0,15 lít.
D. 0,2 lít.
Lời giải:
Áp dụng định luật bảo toàn nguyên tố Natri
nNaCl = nNaOH = 0,3 (mol)
Áp dụng định luật bảo toàn nguyên tố Clo
=> nHCl= nNaCl = 0,3 (mol)
VHCl = 0,32= 0,15 lít
Câu 6. Kim loại được dùng để làm sạch FeSO4 có lẫn tạp chất là CuSO4 là
A. Fe
B. Zn
C. Cu
D. Al
Lời giải:
Kim loại được dùng để làm sạch dung dịch FeSO4 có lẫn tạp chất là CuSO4 là Fe
Sử dụng một lượng dư kim loại Fe
Fe + CuSO4 → FeSO4 + Cu
Lọc bỏ kim loại thu được dung dịch FeSO4 tinh khiết.
Câu 7. Hòa tan Fe3O4 vào dung dịch HCl được dung dịch X. Chia X làm 3 phần:
Thêm KOH dư vào phần 1 được kết tủa Y. Lấy Y để ngoài không khí.
Cho bột Cu vào phần 2.
Sục Cl2 vào phần 3.
Trong các quá trình trên có số phản ứng oxi hoá - khử là
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3+ 4H2O (1)
Phần 1:
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl (2)
FeCl3+ 3NaOH → Fe(OH)3 + 3NaCl (3)
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (4)
Phần 2:
2FeCl3 + Cu → 2FeCl2 + CuCl2 (5)
Phần 3:
2FeCl2 + Cl2 → 2FeCl3 (6)
Các phản ứng oxi hóa khử là : (4), (5), (6).
Câu 8. Cho m gam Mg vào dung dịch chứa 0,18 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 6,72 gam chất rắn. Giá trị của m là
A. 2,88 gam.
B. 4,32 gam.
C. 2,16 gam.
D. 5,04 gam.
Lời giải:
Nếu Mg dư hoặc vừa đủ:
mchất rắn = mFe+ mMg (dư)≥ mFe = 0,18.56 = 10,08 gam
mà chỉ thua được 6,72 gam chất rắn nên Mg phản ứng hết → nFe = 0,12 mol.
Mg (0,09) + 2Fe3+ (0,18 mol) → Mg2+ + 2Fe2+
Mg (0,12) + Fe2+ → Mg2+ (0,12 mol) + Fe
→ nMg = 0,09 + 0,12 = 0,21 mol → mMg= 0,21.24 = 5,04 gam.
Câu 9. Nhận định nào sau đây là sai?
A. FeCl2 vừa có tính khử, vừa có tính oxi hóa.
B. Trong các phản ứng, FeCl3 chỉ thể hiện tính oxi hóa.
C. Cl2 oxi hóa được Br- trong dung dịch thành Br2.
D. Trong dung dịch, cation Fe2+ kém bền hơn cation Fe3+
Lời giải:
Định hướng tư duy giải
A. Đúng vì Fe2+ có số oxi hóa trung gian.
B. Sai vì Fe3+ có thể xuống Fe còn Cl- có thể lên Cl2.
C. Đúng theo tính chất của Cl2.
D. Đúng vì Fe2+ dễ bị oxi hóa thành Fe3+.
Câu 10. Cho các cặp oxi hóa – khử được sắp xếp theo chiều tăng dần tính oxi hóa của dạng oxi hóa như sau: Fe2+/Fe, Cu2+/Cu, Fe3+/Fe2+. Phát biểu nào sau đây là đúng?
A. Cu2+ oxi hóa được Fe2+ thành Fe3+.
B. Fe3+ oxi hóa được Cu thành Cu2+.
C. Cu khử được Fe3+ thành Fe.
D. Fe2+ oxi hóa được Cu thành Cu2+.
Lời giải:
A sai vì Cu2+ không oxi hóa được Fe2+ thành Fe3+.
C sai vì Cu chỉ khử được Fe3+ thành Fe2+.
D sai vì Fe2+ không oxi hóa Cu thành Cu2+.
Câu 11. Sử dụng hóa chất nào sau đây để nhận biết 4 dung dịch mất nhãn sau: KNO3, Cu(NO3)2, AgNO3, Fe(NO3)3
A. Dung dịch NaOH
B. Dung dịch HCl
C. Dung dịch H2SO4
D. Dung dịch NaCl
Lời giải:
KNO3, Cu(NO3)2, AgNO3, Fe(NO3)3
Trích mẫu thử và đánh số thứ tự
Sử dụng dung dịch NaOH để nhận biết
Mẫu thử nào xuất hiện kết tủa xanh, chất ban đầu là Cu(NO3)2
NaOH + Cu(NO3)2 → NaNO3 + Cu(OH)2
Mẫu thử nào xuất hiện kết tủa đỏ nâu thì chất ban đầu là Fe(NO3)3
Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3
Mẫu thử nào xuất hiện kết tủa trắng sau đó hóa đen, thì chất ban đầu là AgNO3
AgNO3 + NaOH → AgOH + NaNO3
AgOH → Ag2O + H2O
Dung dịch không có hiện tượng gì là KNO3
Câu 12. Cho các nhận định sau:
(a) Tính chất hoá học đặc trưng của kim loại là tính khử.
(b) Đồng (Cu) không khử được muối sắt(III) (Fe3+).
(c) Ăn mòn kim loại là một quá trình hoá học trong đó kim loại bị ăn mòn bởi các axit trong môi trường không khí.
(d) Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn vào mặt ngoài vỏ tàu (phần chìm trong nước biển) những khối kẽm.
Số nhận định đúng là
A. 2.
B. 3.
C. 4.
D. 1.
Lời giải:
(a) Tính chất hoá học đặc trưng của kim loại là tính khử.
(d) Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn vào mặt ngoài vỏ tàu (phần chìm trong nước biển) những khối kẽm.
Câu 13. Chia bột kim loại X thành 2 phần. Phần một cho tác dụng với Cl2 tạo ra muối Y. Phần hai cho tác dụng với dung dịch HCl tạo ra muối Z. Cho kim loại X tác dụng với muối Y lại thu được muối Z. Kim loại X có thể là
A. Mg.
B. Al.
C. Zn.
D. Fe.
Lời giải:
Đáp án: D
Kim loại X là Fe
Phần 1: 2Fe (X) + 3Cl2 →t° 2FeCl3 (Y)
Phần 2: Fe (X) + 2HCl → FeCl2 (Z) + H2
Fe (X) + 2FeCl3 (Y) → 3FeCl2 (Z)
Câu 14. Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng
A. Quỳ tím
B. Dung dịch Ba(NO3)2
C. Dung dịch AgNO3
D. Dung dịch NaOH
Lời giải:
Có thể nhận biết một số cation trên dựa vào màu sắc đặc trưng của chúng
Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch muối CuCl2, FeCl3, MgCl2 ta dùng dung dịch NaOH vì tạo các kết tủa có màu khác nhau:
Dung dịch CuCl2 tạo kết tủa xanh: CuCl2 + 2NaOH → Cu(OH)2↓xanh + 2NaCl
Dung dịch FeCl3 tạo kết tủa đỏ nâu: FeCl3 + 3NaOH → Fe(OH)3 ↓đỏ nâu + 3NaCl
Dung dịch MgCl2 tạo kết tủa trắng: MgCl2 + 2NaOH → Mg(OH)2 ↓trắng + 3NaCl
Câu 15. Hoà tan hết cùng một lượng Fe trong dung dịch H2SO4 loãng (dư) và dung dịch H2SO4 đặc, nóng (dư) thì các thế tích khí sinh ra lần lượt là V1 và V2 (đo ở cùng điều kiện). Liên hệ giữa V1 và V2 là
A. V1 = V2
B. V1 = 2V2
C. V2 = 1,5V1.
D. V2 =3V1
Lời giải:
Đáp án: C
Gọi số mol Fe là a mol
Áp dụng định luật bảo toàn số mol electron
Cho Fe vào H2SO4 loãng: 2 = 2nFe
→ = nFe = a mol
Cho Fe vào H2SO4 đặc, nóng: 3nFe = 2
→ = 1,5nFe = 1,5a mol
Ở cùng điều kiện, tỉ lệ về thể tích cũng là tỉ lệ về số mol
→ V2 = 1,5V1.
Câu 16. Trong 3 chất Fe, Fe2+, Fe3+. Chất X chỉ có tính khử, chất Y chỉ có tính oxi hoá, chất Z vừa có tính khử vừa có tính oxi hóa. Các chất X, Y, Z lần lượt là:
A. Fe, Fe2+ và Fe3+.
B. Fe2+, Fe và Fe3+.
C. Fe3+, Fe và Fe2+.
D. Fe, Fe3+ và Fe2+.
Lời giải:
Đáp án: D
+) Fe đơn chất có số oxi hóa bằng 0 → có khả nhường 2e hoặc 3e → chỉ có tính khử → X là Fe
+) Fe2+ có khả năng nhường 1e để thành Fe3+ → có tính khử
Fe2+ có khả năng nhận 2e để thành Fe đơn chất → có tính oxi hóa
→ Z là Fe2+
+) Fe3+ chỉ có khả năng nhận 1e để trở nhà Fe2+ hoặc nhận 3e để thành Fe đơn chất → Fe3+ chỉ có tính oxi hóa → Y là Fe3+
Câu 17. Cho Fe tác dụng với dd HNO3 đặc, nóng, thu được khí X màu nâu đỏ. Khí X là
A. N2
B. N2O
C. NO
D. NO2
Lời giải:
Đáp án: D
N2: Khí không màu, nhẹ hơn không khí
N2O: Khí không màu, nặng hơn không khí.
NO: Khí không màu, hóa nâu ngoài không khí.
NO2: Khí màu nâu đỏ
Câu 18. Phát biểu nào sau đây không đúng?
A.Kim loại Fe phản ứng với dung dịch HCl tạo ra muối sắt(II).
B.Dung dịch FeCl3 phản ứng được với kim loại Fe.
C.Kim loại Fe không tan trong dung dịch H2SO4 đặc, nguội.
D.Trong các phản ứng hóa học, ion Fe2+ chỉ thể hiện tính khử.
Lời giải:
Đáp án: D
A. Đúng
Fe + 2HCl → FeCl2 + H2
B. Đúng
Fe + 2FeCl3 → 3FeCl2
C. Đúng. Fe không phản ứng với H2SO4 đặcnguội, HNO3 đặc nguội.
D. Sai, ion Fe2+ ở mức oxi hóa trung gian nên có thể tăng hoặc giảm số oxi hóa → thể hiện cả tính khử, cả tính oxi hóa.
Câu 19. Hòa tan 2,24 gam Fe bằng 300 ml dung dịch HCl 0,4 M , thu được dung dịch X và khí H2. Cho dung dịch AgNO3 dư vào X, thu được khí NO (sản phẩm khử duy nhất của ) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 18,3.
B. 8,61.
C. 7,36.
D. 9,15.
Lời giải:
Đáp án: A
nFe = 0,04 mol; nHCl = 0,3.0,4 = 0,12 mol
Dung dịch X gồm: HCl dư = 0,12 – 0,08 = 0,04 mol và FeCl2: 0,04 mol
Cho AgNO3 dư vào X có phản ứng:
→ m = 0,01.108 + 0,12.143,5 = 18,3 gam.
Câu 20. Ngâm một lá kim loại có khối lượng 50g trong dung dịch HCl. Sau khi thu được 336ml H2 (đkc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là
A. Zn
B. Fe
C. Al
D. Ni
Lời giải:
Đáp án: B
Khối lượng kim loại phản ứng là:
mKL = = 0,84 gam
= 0,336 : 22,4 = 0,015 mol
2M + 2nHCl → 2MCln + nH2
Số mol của M là:
nM = .= .0,015 = mol
→ MM = = 0,84 : = 28n
Với n = 1 → MM = 28 loại
n = 2 → MM = 56 (Fe) Thỏa mãn
n = 3 → MM = 84 loại.
Vậy kim loại cần tìm là Fe
Xem thêm các phương trình hóa học khác:
FeCl2 + AgNO3 → Fe(NO3)2 + AgCl |FeCl2 ra AgCl
Fe + Cl2 → FeCl3 | Fe ra FeCl3
SO2 + Cl2 + H2O → HCl + H2SO4 | SO2 ra H2SO4
H2S + Cl2 + H2O → H2SO4 + HCl | H2S ra H2SO4
KOH + Cl2 → KCl + KClO + H2O | KOH ra KCl | KOH ra KClO | Cl2 ra KCl | Cl2 ra KClO