Phản ứng Fe + Cl2 FeCl3
1. Phương trình phản ứng Fe ra FeCl3
2Fe + 3Cl2(khí, vàng lục) 2FeCl3( rắn, nâu đỏ)
2. Điều kiện phản ứng Fe cộng Cl2
Nhiệt độ: > 250oC
3. Cách thực hiện phản ứng Fe ra FeCl3
Cho dây sắt quấn hình lò xo (đã được nung nóng đỏ) vào lọ đựng khí clo.
4. Hiện tượng nhận biết phản ứng Fe tác dụng Cl2
Sắt cháy sáng tạo thành khói màu nâu đỏ
Sắt đă phản ứng với khí clo tạo thành sắt (III) clorua
5. Bản chất các chất tham gia phản ứng
5.1. Bản chất của Fe (Sắt)
- Trong phản ứng trên Fe là chất khử.
- Fe là kim loại có tính khử trung bình tác dụng được với các phi kim như: S, O2, Cl2 ...
5.2. Bản chất của Cl2 (Clo)
- Trong phản ứng trên Cl2 là chất oxi hoá.
- Clo có khả năng cho phản ứng với hầu hết các kim loại (trừ Au và Pt) ở điều kiện nhiệt độ để tạo thành các muối halogenua.
6. Tính chất hóa học của Fe
6.1. Tác dụng với phi kim
Với oxi: 3Fe + 2O2 Fe3O4
Với clo: 2Fe + 3Cl2 2FeCl3
Với lưu huỳnh: Fe + S FeS
Ở nhiệt độ cao, sắt phản ứng được với nhiều phi kim.
6.2. Tác dụng với dung dịch axit
Tác dụng với với HCl, H2SO4 loãng
Fe + 2HCl → FeCl2 + H2
Tác dụng với H2SO4 đặc, nóng; HNO3 đặc:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Không tác dụng với H2SO4 đặc nguội, HNO3 đặc, nguội
6.3. Tác dụng với dung dịch muối
Đẩy được kim loại yếu hơn ra khỏi muối
Fe + CuSO4 → FeSO4 + Cu
7. Bài tập vận dụng liên quan
Câu 1. Cho clo vào nước, thu được nước clo. Biết clo tác dụng không hoàn toàn với nước. Nước clo là hỗn hợp gồm các chất:
A. HCl, HClO
B. HClO, Cl2, H2O
C. H2O, HCl, HClO
D. H2O, HCl, HClO, Cl2
Lời giải:
Cl2 có phản ứng với nước như sau:
H2O + Cl2 ⇔ HCl + HClO (axit clohiđric và axit hipoclorơ)
Nó là hỗn hợp của dung dịch gồm Cl2, axit HCl và HClO có màu vàng lục nhạt và mùi rất hắc
Trong nước Clo có chứa Cl2, HCl, HClO, H2O.
Câu 2. Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. điện phân dung dịch NaCl có màng ngăn.
D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl.
Lời giải:
Phương pháp điều chế Cl2 trong phòng thí nghiệm là cho HCl tác dụng với các chất có tính oxh mạnh
4HCl + MnO2 MnCl2 + Cl2 + 2H2O
Câu 3. Chất dùng để làm khô khí Cl2 ẩm là
A. dung dịch H2SO4 đậm đặc.
B. Na2SO3 khan.
C. CaO.
D. dung dịch NaOH đặc.
Lời giải:
Dung dịch H2SO4 đậm đặc được dùng để làm khô khí Cl2 ẩm
Câu 4. Phản ứng xảy ra khi đốt cháy sắt trong không khí là
A. 3Fe + 2O2 → Fe3O4.
B. 4Fe + 3O2 → 2Fe2O3.
C. 2Fe + O2 → 2FeO.
D. tạo hỗn hợp FeO, Fe2O3, Fe3O4.
Lời giải:
Câu 5. Chất nào dưới đây phản ứng với Fe tạo thành hợp chất Fe(II)?
A. Cl2
B. dung dịch HNO3 loãng
C. dung dịch AgNO3 dư
D. dung dịch HCl đặc
Lời giải:
A. Fe + Cl2 FeCl3
B. Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
C. Fe + 2AgNO3 → Fe(NO3)2+ 2Ag
Fe(NO3)2 + AgNO3 → Fe(NO3)3+ Ag
D. Fe + HCl → FeCl2
Câu 6. Cho 5,4 gam hỗn hợp 2 kim loại Fe và Zn tác dụng hoàn toàn với 90 ml dung dịch HCl 2M. Khối lượng muối thu được là
A. 11,79 gam
B. 11,5 gam
C. 15,71 gam
D. 17,19 gam
Lời giải:
nHCl = 0,09. 2 = 0,18 (mol)
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
Từ (1) và (2) nH2 = 12nHCl = 0,09 (mol)
Theo định luật bảo toàn khối lượng
mhỗn hợp + maxit = mmuối + mhidro
=> mmuối = 5,4 + 0,18.36,5 - 0,09.2 = 11,79 gam
Câu 7. Cho 3,92 gam một kim loại chưa biết hóa trị tác dụng hoàn toàn với dung dịch H2SO4 loãng, thu được 10,64 gam muối sunfat. Kim loại đã dùng là:
A. Mg
B. Al
C. Zn
D. Fe
Lời giải:
Gọi kim loại cần tìm là M có hóa trị n, công thức của muối sunfat là M2(SO4)n
2M + nH2SO4 → M2(SO4)n + nH2
2M gam (2M + 96n) gam
3,92 gam 10,64 gam
=> 2M. 10,64 = 3,92.(2M + 96n) => M = 28n
Biện luận để được kim loại là Fe
Vậy M là Fe => Công thức oxit: Fe2O3
Câu 8. Muối Fe(NO3)2 có lẫn ít muối AgNO3. Có thể dùng kim loại nào sau đây để làm sạch dung dịch Fe(NO3)2?
A. Zn
B. Fe
C. Cu
D. Ag
Lời giải:
Câu 9. Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất của N+5, ở đktc). Giá trị của m và V lần lượt là:
A. 10,8 và 4,48.
B. 10,8 và 2,24.
C. 17,8 và 4,48.
D. 17,8 và 2,24.
Lời giải:
Sau phản ứng thu được hỗn hợp bột kim loại nên Fe còn dư, phản ứng tạo muối Fe2+
Số mol các chất có trong bài là:
nCu2+ = nCu(NO3)2 = 0,8.0,2 = 0,16 mol;
nNO3- = 2nCu(NO3)2 = 2. 0,16 = 0,32 mol;
nH+ = 2nH2SO4 = 0,4 mol
Phương trình phản ứng ion
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,15 ← 0,4 → 0,1 → 0,1
Fe + Cu2+ → Fe2+ + Cu
0,16 ← 0,16 → 0,16
Vậy nFe pư = 0,15 + 0,16 = 0,31 mol
=> mKL sau = mFe dư + mCu => m - 0,31.56 + 0,16.64 = 0,6m
=> m = 17,8 gam
=> VNO = 0,1.22,4 = 2,24 lít
Câu 10. Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe (III) ?
A. HCl, HNO3 đặc, nóng, H2SO4 đặc, nóng
B. Cl2, HNO3 nóng, H2SO4 đặc, nguội
C. bột lưu huỳnh, H2SO4 đặc, nóng, HCl
D. Cl2, AgNO3, HNO3 loãng
Lời giải:
Câu 8. Dung dịch FeSO4 không làm mất màu dung dịch nào sau đây?
A. Dung dịch KMnO4 trong môi trường H2SO4
B. Dung dịch K2Cr2O7 trong môi trường H2SO4
C. Dung dịch Br2
D. Dung dịch CuCl2
Lời giải:
Câu 11. Cho 11,36 gam hồn hợp gồm Fe, FeO, Fe2O3, Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Dung dịch X có thể hoà tan tối đa 12,88 gam Fe. Số mol HNO3 có trong dung dịch ban đầu là
A. 0,88.
B. 0,64.
C. 0,94.
D. 1,04.
Lời giải:
Quy đổi hỗn hợp gồm có x mol Fe và y mol O
Ta có 56x + 16y= 11,36 (1)
Ta có nNO= 0,06 mol
Qúa trình cho e :
Fe → Fe3+ + 3e
x → 3x mol
Qúa trình nhận e :
O + 2e→ O-2
y → 2y mol
N+5+ 3e → NO
0,18 ← 0,06
Theo định luật bảo toàn electron thì: ne cho= ne nhận nên 3x = 2y + 0,18 (2)
Từ (1) và (2) ta có x= 0,16 và y= 0,15
Bảo toàn nguyên tố Fe có nFe(NO3)3= nFe= x = 0,16 mol
nFe hình thành= 0,23 mol
Fe + 4HNO3 → 2H2O + NO + Fe(NO3)3
x → 4x → x
Fe + 2Fe(NO3)3→ 3Fe(NO3)2
0,23 - x → x + 0,16
=> x= 0,1 → nHNO3 = 4.0,1 + 3.0,16 + 0,06 = 0,94 mol
Câu 12. Cho bột Fe vào dung dịch gồm AgNO3 và Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Hai muối trong X và hai kim loại trong Y lần lượt là:
A. Cu(NO3)2; AgNO3 và Cu; Ag.
B. Cu(NO3)2; Fe(NO3)2và Cu; Fe
C. Fe(NO3)2 ; Fe(NO3)3 và Cu; Ag
D. Cu(NO3)2; Fe(NO3)2 và Cu; Ag
Lời giải:
2 kim loại là Cu và Ag => AgNO3 phải hết
2 muối gồm Fe(NO3)2 và Cu(NO3)2
Phương trình phản ứng theo thứ tự sau
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Câu 13. Trong các phát biểu sau, câu nói sau đây đúng?
A. Kim loại Fe phản ứng với dung dịch HCl tạo ra muối sắt (III).
B. Kim loại Fe không tan trong dung dịch H2SO4 đặc nguội
C. Trong các phản ứng hóa học, ion Fe2+ chỉ thể hiện tính khử
D. Dung dịch FeCl3 không phản ứng được với kim loại Fe
Lời giải:
Fe phản ứng với HCl thu được muối sắt (II) => A sai
Vì Fe2+ thể hiện tính oxi hóa khi tác dụng với kim loại Mg:
Mg + Fe2+ → Mg2+ + Fe => C sai
Fe + 2FeCl3 → 3FeCl2 => D sai
Câu 14. Để điều chế Fe(NO3)2 có thể dùng phương pháp nào trong các phương pháp sau?
A. Ba(NO3)2 + FeSO4
B. Fe(OH)2 + HNO3
C. Fe + HNO3 dư
D. FeO + NO2
Lời giải:
Để điều chế Fe(NO3)2, có thể cho Ba(NO3)2 tác dụng với FeSO4
Ba(NO3)2 + FeSO4 → Fe(NO3)2 + BaSO4↓
Câu 15. Nung nóng hỗn hợp Mg(OH)2 và Fe(OH)2 ngoài không khí cho đến khi khối lượng không thay đổi thu được chất rắn X. X chứa
A. MgO, FeO.
B. Mg(OH)2, Fe(OH)2.
C. Fe, MgO.
D. MgO, Fe2O3.
Lời giải:
Phương trình phản ứng:
Mg(OH)2 → MgO + H2O
4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O
Câu 16. Để bảo quản dung dịch FeSO4 trong phòng thí nghiệm, người ta cần thêm vào bình chất nào dưới đây
A. Một đinh Fe sạch.
B. Dung dịch H2SO4 loãng.
C. Một dây Cu sạch.
D. Dung dịch H2SO4đặc.
Lời giải:
Người ta dùng đinh Fe sạch để sắt khử muối sắt(III) thành muối sắt(II):
Fe + Fe2(SO4)3 → 3FeSO4
Câu 17. Ngâm thanh Cu (dư) vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe (dư) vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
A. Fe(NO3)3.
B. Fe(NO3)2.
C. Fe(NO3)2, Cu(NO3)2
D. Fe(NO3)3, Fe(NO3)2.
Lời giải:
Đáp án: B
Các phản ứng xảy ra:
Cu(dư) + AgNO3 → Cu(NO3)2 + Ag
Cu(NO3)2 + Fe(dư) → Fe(NO3)2 + Cu
Vậy dung dịch Y chứa Fe(NO3)2.
Câu 18. Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam FeCl3. Giá trị của m là
A. 2,24
B. 2,8
C. 1,12
D. 0,56
Lời giải:
Đáp án: A
nFeCl3 = 6,5 : 162,5 = 0,04 mol
Bảo toàn nguyên tố Fe:
nFe = nFeCl3 = 0,04 mol
→ mFe = 0,04.56 = 2,24 gam
Câu 19. Chia bột kim loại X thành 2 phần. Phần một cho tác dụng với Cl2 tạo ra muối Y. Phần hai cho tác dụng với dung dịch HCl tạo ra muối Z. Cho kim loại X tác dụng với muối Y lại thu được muối Z. Kim loại X có thề là
A. Mg.
B. Al.
C. Zn.
D. Fe.
Lời giải:
Đáp án: D
Kim loại X là Fe
Phần 1: 2Fe (X) + 3Cl2 →t° 2FeCl3 (Y)
Phần 2: Fe (X) + 2HCl → FeCl2 (Z) + H2
Fe (X) + 2FeCl3 (Y) → 3FeCl2 (Z)
Câu 20. Ngâm một lá kim loại có khối lượng 50g trong dung dịch HCl. Sau khi thu được 336ml H2 (đkc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là
A. Zn
B. Fe
C. Al
D. Ni
Lời giải:
Đáp án: B
Khối lượng kim loại phản ứng là:
mKL = = 0,84 gam
= 0,336 : 22,4 = 0,015 mol
2M + 2nHCl → 2MCln + nH2
Số mol của M là:
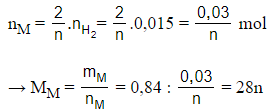
Với n = 1 → MM = 28 loại
n = 2 → MM = 56 (Fe) Thỏa mãn
n = 3 → MM = 84 loại.
Vậy kim loại cần tìm là Fe
Xem thêm các phương trình hóa học liên quan khác:
Fe + H2SO4 → FeSO4 + H2 | Fe ra FeSO4
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O | Fe ra Fe2(SO4)3
Fe + HNO3 → Fe(NO3)3 + NO + H2O | Fe ra Fe(NO3)3




