CaCO3 + 2CH3COOH → (CH3COO)2Ca + H2O + CO2 ↑
1. Điều kiện phản ứng
- Không có
2. Cách thực hiện phản ứng
- Cho CaCO3 tác dụng với CH3COOH
3. Hiện tượng nhận biết phản ứng
- Canxi cacbonat phản ứng với axit axetic trong nước tạo thành canxi axetat và khí cacbonic.
4. Mở rộng về tính chất hóa học của CH3COOH và CaCO3
4.1. Tính chất hóa học của CH3COOH
Axit axetic CH3COOH (etanoic) là một axit hữu cơ, mạnh hơn axit cacbonic. Nó được tào thành bằng việc liên kết nhóm methyl CH3 với cacboxyl COOH.
- Phản ứng thế halogen vào gốc hydrocacbon ( 90 - 100oC):
Cl2 + CH3COOH → ClCH2COOH + HCl
- Tác dụng với axetylen (xúc tác thủy ngân, nhiệt độ 70 - 80oC) thành etyl diaxetat:
C2H2 + 2CH3COOH → CH3CH(OCOCH3)2
- Tác dụng với amoniac tạo thành amid:
NH3 + CH3COOH → NH3CH3COOHNH4
- Phản ứng decacboxyl hóa thành axeton (Xúc tác mangan oxit, nhiệt độ):
C2H2 + CH3COOH → CH2CHOCOCH3
4.2. Tính chất hóa học của CaCO3
- Mang đầy đủ tính chất hóa học của muối:
- Tác dụng với axit mạnh:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
- Kém bền với nhiệt:
CaCO3 to→ CaO + CO2
- CaCO3 tan dần trong nước có hòa tan khí CO2:
CaCO3 + CO2 + H2O ⇆ Ca(HCO3)2
→ Khi đun nóng:
Ca(HCO3)2 to→CaCO3↓ + CO2 + H2O
5. Bạn có biết
Các muối Na2CO3, K2CO3 cũng có phản ứng tương tự với axit axetic
6. Ví dụ minh họa
Ví dụ 1: Cấu hình electron lớp ngoài cùng của kim loại Ca là:
A. 1s1 B. 2s1
C. 4s2 D. 3s2
Đáp án C
Hướng dẫn giải:
Cấu hình electron của Ca: 1s22s22p63s23p64s2
Ví dụ 2: Ứng dụng nào sau đây không phải của thạch cao nung (CaSO4.H2O)?
A. Bó bột khi gẫy xương.
B. Đúc khuôn.
C. Thức ăn cho người và động vật.
D. Năng lượng.
Đáp án C
Hướng dẫn giải:
Vì thạch cao không ăn được.
Ví dụ 3: Từ đá vôi (CaCO3), điều chế Ca bằng cách:
A. Dùng kali đẩy canxi ra khỏi CaCO3
B. Điện phân nóng chảy CaCO3
C. Nhiệt phân CaCO3
D. Hòa tan với dd HCl rồi điện phân nóng chảy sản phẩm
Đáp án D
Hướng dẫn giải:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
CaCl2 → Ca + Cl2 ↑
7. Bài tập vận dụng liên quan (có đáp án)
Câu 1: Hòa tan hoàn toàn 20 gam CaCO3 vào đung dịch CH3COOH. Thể tích CO2 thoát ra ở đktc là
A. 1,12 lít
B. 5,6 lít
C. 4,48 lít
D. 13,44 lít
Lời giải:
Đáp án C
Số mol của CaCO3 là:
nCaCO3=20100= 0,2 mol
Phương trình phản ứng:
CaCO3+2CH3COOH→(CH3COO)2Ca+CO2+H2O0,2
Theo phương trình phản ứng ta có:
= 0,2 mol
Thể tích CO2 thoát ra ở đktc là
= 0,2.22,4 = 4,48 lít
Câu 2: Cho sơ đồ phản ứng:
CH3COOH + Na→CH3COONa + H2
Tổng hệ số các chất (là các số nguyên, tối giản) trong phản ứng trên là
A. 5
B. 6
C. 7
D. 8
Lời giải:
Đáp án C
Phương trình phản ứng:
2CH3COOH + 2Na → 2CH3COONa + H2
Tổng hệ số các chất trong phương trình phản ứng trên là:
2 + 2 + 2 + 1 = 7
Câu 3: Nhiệt phân hoàn toàn m gam hỗn hợp X gồm (MgCO3, BaCO3, CaCO3, CuCO3), sau phản ứng thu được 100 gam hỗn hợp các oxit và V lít CO2 (đktc). Sục toàn bộ V lít CO2 (đktc) vào nước vôi trong dư thu được 89 gam kết tủa. Giá trị của m là:
A. 139,16 B. 110,68 C. 189 D. 123,06
Lời giải:
Đáp án: A
nCO2 = nCaCO3 = 89/100 = 0,89 mol ⇒ mCO2 = 0,89.44 = 39,16 gam
mX = 100 + 39,16 = 139,16 gam)
Câu 4: Một loại đá vôi chứa 80% CaCO3 còn lại là tạp chất trơ. Nung m gam đá này một thời gian thu được 0,78m gam chất rắn. Hiệu suất phân hủy CaCO3 là
A. 78%. B. 50%. C. 62,5%. D. 97,5%.
Lời giải:
Đáp án: C
mCaCO3 ⇒ 44a = m – 0,78m ⇒ a = 0,005m
Câu 5: Khối lượng Na2CO3 cần dùng để phản ứng hết với 50 gam axit axetic 30% là
A. 13,25 gam.
B. 15,23 gam.
C. 12,35 gam.
D. 15,55 gam.
Lời giải:
Đáp án A
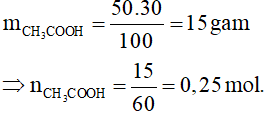
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
0,25 ………….0,125 mol
Câu 6: Hòa tan hoàn toàn 4,8 gam Mg vào dung dịch CH3COOH, sau phản ứng thấy thoát ra V lít khí H2 ở đktc. Giá trị của V là
A. 4,48 lít
B. 5,60 lít
C. 3,36 lít
D. 9,80 lít
Lời giải:
Đáp án A
Số mol của Mg là:
nMg = = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có:
= 0,2 mol
Thể tích khí H2 là:
V = 0,2.22,4 = 4,48 lít
Xem thêm các phương trình hóa học hay khác:
CH3COOH + Na → CH3COONa + H2 | CH3COOH ra CH3COONa
CH3COOH + CuO → (CH3COO)2Cu + H2O | CH3COOH ra (CH3COO)2Cu
C2H5OH + O2 → CH3COOH + H2O | C2H5OH ra CH3COOH | Rượu etylic ra axit axetic





