Cách nhận biết ion NO3-
I. Cách nhận biết ion NO3-
- Để nhận biết ion NO3- trong dung dịch ta có thể dùng bột Cu hoặc một vài mẩu lá Cu mỏng trong môi trường axit (axit sunfuric loãng)
- Hiện tượng: Bột Cu tan ra tạo thành dung dịch màu xanh, khí NO không màu bay lên gặp oxi của không khí, tạo thành khí NO2 có màu nâu đỏ.
+ Phương trình hóa học minh họa:
3Cu + 8H+ + 2 NO3- → 3Cu2+ + 2NO↑ + 4H2O
2NO (không màu) + O2 → 2NO2(màu nâu đỏ)
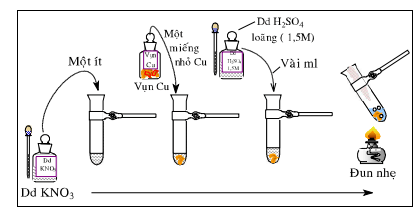
II. Bài tập nhận biết ion NO3-
Bài 1: Có 3 lọ riêng biệt đựng ba dung dịch không màu, mất nhãn là HCl, HNO3, H2SO4. Có thể dùng thuốc thử nào dưới đây để phân biệt 3 dung dịch trên?
A.giấy quỳ tím, dung dịch NaOH
B.dung dịch BaCl2; Cu
C.dung dịch AgNO3; Na2CO3
D.dung dịch phenolphtalein
Hướng dẫn giải
Đáp án B
- Trích mẫu thử của 3 dung dịch ra 3 ống nghiệm có đánh số.
- Cho lần lượt từng mẫu thử tác dụng với BaCl2
+ Mẫu thử phản ứng với BaCl2 xuất hiện kết tủa trắng là H2SO4.
BaCl2 + H2SO4 BaSO4 ¯ + 2HCl
+ Hai mẫu còn lại không có hiện tượng gì.
- Tiếp tục cho hai mẫu còn lại lần lượt tác dụng với kim loại Cu.
+ Mẫu thử hòa tan Cu giải phóng khí không màu hóa nâu trong không khí là HNO3.
3Cu + 8HNO3 3Cu(NO3)2 + 2NO↑ + 4H2O
2NO + O2 → 2NO2(màu nâu đỏ)
+ Mẫu thử không có hiện tượng gì xuất hiện là HCl.
Bài 2: Cho dung dịch chứa anion NO3-, CO32-. Hãy nêu cách nhận biết từng ion trong dung dịch đó. Viết các phương trình hóa học minh họa.
Hướng dẫn giải
- Sử dụng BaCl2nếuxuất hiện kết tủa trắng → dung dịch chứa CO32-
Ba2+ + CO32- → BaCO3 ↓
- Tiếp tục cho một ít bột Cu vào mẫu thử thêm vài giọt H2SO4loãng nếu thấy thoát ra khí không màu (NO) hóa nâu đỏ (NO2) ngoài không khí thì mẫu thử đó chứa NO3-
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
2NO (không màu) + O2 → 2NO2(màu nâu đỏ)
Xem thêm các bài viết về cách nhận biết các chất hóa học hay và chi tiết khác:




