Cách nhận biết axit cacbonic (H2CO3)
I. Cách nhận biết axit cacbonic
Axit cacbonic là một axit yếu, không phân li hoàn toàn trong nước:
H2CO3 ⇄ H+ +HCO3-
Axit cacbonic cũng không bền, dễ bị phân hủy:
H2CO3 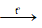 CO2↑ + H2O
CO2↑ + H2O
- Cách nhận biết: Dùng quỳ tím
- Hiện tượng: Quỳ tím hóa đỏ nhạt
Ngoài ra, chúng ta có thể dùng dung dịch Ca(OH)2 hoặc Ba(OH)2 dư để nhận biết.
+ Hiện tượng: Xuất hiện kết tủa màu trắng
+ Phương trình hóa học:
H2CO3 + Ba(OH)2 → BaCO3↓ + 2H2O
H2CO3 + Ca(OH)2 → CaCO3↓ + 2H2O
II. Bài tập nhận biết axit cacbonic
Bài 1: Nêu hiện tượng khí nhúng từng mẩu quỳ tím vào từng dung dịch sau: Na2SO4, HCl, H2SO4, BaCl2, Ba(OH)2, Na2CO3, NaOH, H2CO3.
Hướng dẫn giải:
- Quỳ tím chuyển sang màu đỏ: HCl, H2SO4, H2CO3 (đỏ nhạt).
- Quỳ tím chuyển sang màu xanh: Ba(OH)2, Na2CO3, NaOH.
- Quỳ tím không đổi màu: Na2SO4 và BaCl2.
Bài 2: Chỉ dùng dung dịch Ba(OH)2 thì phân biệt được bao nhiêu dung dịch trong dãy sau: H2CO3, Na2SO4, HCl, Na2CO3?
Hướng dẫn giải:
- Khi nhỏ Ba(OH)2 vào các mẫu thử, hiện tượng:
+ Xuất hiện kết tủa trắng: H2CO3, Na2SO4, Na2CO3 (nhóm I)
H2CO3 + Ba(OH)2 → BaCO3↓ + 2H2O
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
Na2CO3 + Ba(OH)2 → BaCO3↓ + 2NaOH
+ Không hiện tượng: HCl
- Dùng HCl đã nhận biết nhỏ vào các kết tủa tương ứng của các chất nhóm I:
+ Kết tủa tan và có khí thoát ra: BaCO3 hay chất ban đầu là H2CO3 hoặc Na2CO3
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
+ Kết tủa không tan: BaSO4 hay chất ban đầu là Na2SO4.
- Dùng HCl đã nhận biết nhỏ vào các mẫu thử còn lại (H2CO3 hoặc Na2CO3)
+ Có khí không màu thoát ra: Na2CO3
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
+ Không hiện tượng: H2CO3.
→ Phân biệt được cả 4 dung dịch.
Xem thêm các bài viết về cách nhận biết các chất hóa học hay và chi tiết khác:
Cách nhận biết axit photphoric (H3PO4)
Cách nhận biết axit sunfurơ (H2SO3)
Cách nhận biết axit flohiđric (HF)




