Phản ứng Al2(SO4)3 + NaOH→ Al(OH)3 + Na2SO4
1. Phương trình phản ứng Al2(SO4)3 ra Al(OH)3
Al2(SO4)3 + 6NaOH→ 2Al(OH)3 + 3Na2SO4
2. Điều kiện phản ứng xảy ra Al2(SO4)3 ra Al(OH)3
Nhiệt độ thường, dung dịch NaOH tác dụng vừa đủ.
3. Hiện tượng phản ứng khi Al2(SO4)3 tác dụng với NaOH vừa đủ
Xuất hiện kết tủa keo trắng nhôm hidroxit (Al(OH)3) trong dung dịch.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Al2(SO4)3 (Nhôm sunfat)
Al2(SO4)3 mang đầy đủ tính chất hoá học của muối tác dụng được với dung dịch bazo như KOH, NaOH, ...
4.2. Bản chất của NaOH (Natrihidroxit)
NaOH là một bazo mạnh phản ứng được với muối.
5. NaOH dư tác dụng với Al2(SO4)3
Khi cho từ từ dung dịch NaOH vào dung dịch Al2(SO4)3 cho tới dư, xuất hiện kết tủa màu trắng, lượng kết tủa tăng dần đến cực đại và sau đó kết tủa tan ra cho đến hết, dung dịch trở nên trong suốt
Al2(SO4)3 + 8NaOH → 3Na2SO4 + 2NaAlO2 + 4H2O
6. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
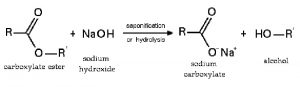
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
7. Mở rộng kiến thức về Al2(SO4)3
7.1. Tính chất vật lí & nhận biết
- Tính chất vật lí : Là chất rắn, có màu trắng, dễ hút ẩm.
- Nhận biết: Cho dung dịch nhôm clorua tác dụng với dung dịch BaCl2, thấy xuất hiện kết tủa trắng:
Al2(SO4)3 + 3BaCl2 → 3BaSO4↓ + 2AlCl3
7.2. Tính chất hóa học
Mang đầy đủ tính chất hóa học của muối
- Tác dụng với dung dịch bazo:
Al2(SO4)3 + 6KOH(vừa đủ) → 3K2SO4 + 2Al(OH)3
- Tác dụng với dung dịch muối khác:
Al2(SO4)3 + Ba(NO3)2 → 3BaSO4↓ + 2Al(NO3)3
- Phản ứng với kim loại mạnh hơn:
3Mg + Al2(SO4)3 → 3MgSO4 + 2Al
7.3. Điều chế
- Cho hiđroxit nhôm, Al(OH)3 tác dụng với axit sunfuric:
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 +6H2O
- Cho kim loại nhôm trong dung dịch axit sunfuric:
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
8. Bài tập vận dụng liên quan
Câu 1. Kim loại Al không phản ứng với dung dịch?
A. H2SO4 đặc, nguội.
B. HNO3 loãng.
C. HCl.
D. NaOH.
Lời giải:
Câu 2. Cho sơ đồ phản ứng : Al → A → Al2O3 → Al. A có thể là
A. AlCl3.
B. NaAlO2.
C. Al(NO3)3.
D. Al2(SO4)3.
Lời giải:
Câu 3. Kim loại Al không phản ứng với dung dịch?
A. H2SO4 đặc, nguội.
B. HNO3 loãng.
C. HCl.
D. NaOH.
Lời giải:
Câu 4. Vật liệu bằng nhôm khá bền trong không khí là do
A. nhôm không thể phản ứng với oxi.
B. có lớp hidroxit bảo vệ.
C. có lớp oxit bảo vệ.
D. nhôm không thể phản ứng với nitơ.
Lời giải:




