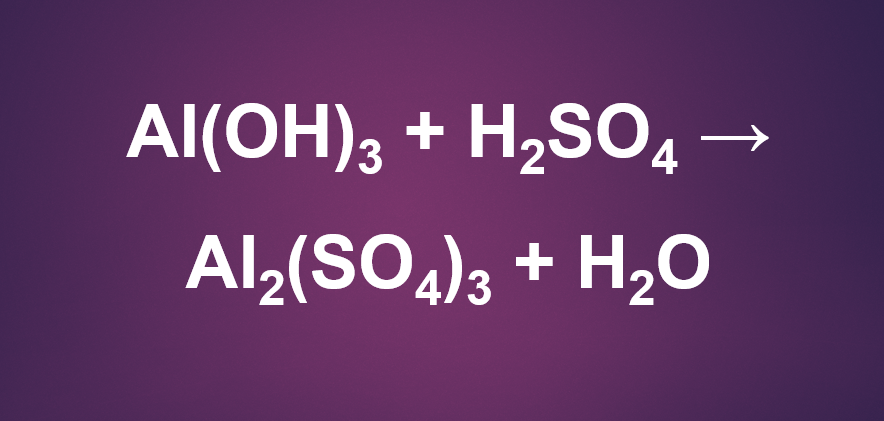Phương trình 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
1. Phương trình phản ứng hóa học:
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
2. Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm hiđroxit và tạo dung dịch trong suốt.
3. Điều kiện phản ứng
- Điều kiện thường.
4. Tính chất hoá học
4.1. Tính chất hoá học của Al(OH)3
Kém bền với nhiệt: Khi đun nóng Al(OH)3 phân hủy thành Al2O3.
2Al(OH)3 
- Là hiđroxit lưỡng tính:
Tác dụng với axit mạnh:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Tác dụng với dung dịch kiềm mạnh:
Al(OH)3 + KOH → KAlO3 + 2H3O
Al(OH)3 + KOH → K[Al(OH)4]
4.2. Tính chất hoá học của H2SO4
Axit sunfuric loãng
- Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb)
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo
FeO + H2SO4 → FeSO4 + H2O
- Tác dụng với bazo
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- Tác dụng với muối
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
Axit sunfuric đặc
- Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
5. Cách thực hiện phản ứng
- Cho Al(OH)3 phản ứng với dung dịch axit H2SO4 đặc hoặc loãng tạo muối nhôm sunfat và nước.
6. Bạn có biết
- Các hidroxit kim loại có hóa trị cao nhất tác dụng với dung dịch H2SO4 thu được muối hóa trị cao nhất và nước.
7. Bài tập liên quan
Câu 1: Trong các chất dưới đây chất nào không tác dụng với H2SO4 loãng?
A. Cu.
B. Al(OH)3.
C. Fe.
D. BaCl2.
Hướng dẫn giải
Chọn A.
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Fe + H2SO4 → FeSO4 + H2↑
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Câu 2: Cho dãy các chất: Ag, K, Na2O, NaHCO3 và Al(OH)3. Số chất trong dãy tác dụng được với dung dịch H2SO4 loãng là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Chọn D.
Các chất tác dụng với dung dịch H2SO4 loãng là K, Na2O, NaHCO3, Al(OH)3.
Câu 3: Nhôm bền trong môi trường không khí và nước là do:
A. Nhôm là kim loại kém hoạt động.
B. Có màng oxit Al2O3 bền vững bảo vệ.
C. Có màng hidroxit Al(OH)3 bền vững bảo vệ.
D. Nhôm có tính thụ động với không khí và nước.
Hướng dẫn giải
Chọn B.
Nhôm để ngoài không khí sẽ tạo thành một lớp màng mỏng Al2O3 bền vững bảo vệ.
Câu 4: Dung dịch H2SO4 đặc phản ứng được với tất cả các chất trong dãy nào sau đây?
A. BaCl2, Na2CO3, Al(OH)3.
B. FeCl3, Al2O3, Cu.
C. CuO, NaCl, CuS.
D. Al2O3, NaCl, Ag.
Hướng dẫn giải
Chọn A.
B sai, FeCl3 không tác dụng với dung dịch H2SO4 đặc.
C sai, CuS, NaCl không tác dụng với dung dịch H2SO4 đặc.
D sai, NaCl không tác dụng với dung dịch H2SO4 đặc.
Câu 5. Nhôm bền trong môi trường nước và không khí là do
A. nhôm là kim loại kém hoạt động.
B. có màng oxit Al2O3 bền vững bảo vệ.
C. có màng hiđroxit Al(OH)3 bền vững bảo vệ.
D. nhôm có tính thụ động với không khí và nước.
Hướng dẫn giải:
Đáp án: B
Nhôm là kim loại hoạt động mạnh.Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước, kể cả khi đun nóng.
Xem thêm các phương trình hóa học khác:
Al + H2O → Al(OH)3↓ + H2↑ | Al ra Al(OH)3
Al + HNO3 -> Al(NO3)3 + N2 + N2O + H2O| Al ra N2 + N2O
Phản ứng nhiệt phân: Al(NO3)3 → Al2O3 + NO2↑ + O2↑ | Al(NO3)3 ra Al2O3 | Al(NO3)3 ra NO2
Al + H2SO4 → Al2(SO4)3 + S + H2O | Al ra Al2(SO4)3
NaAlO2 + HCl + H2O → Al(OH)3 + NaCl | NaAlO2 ra NaCl