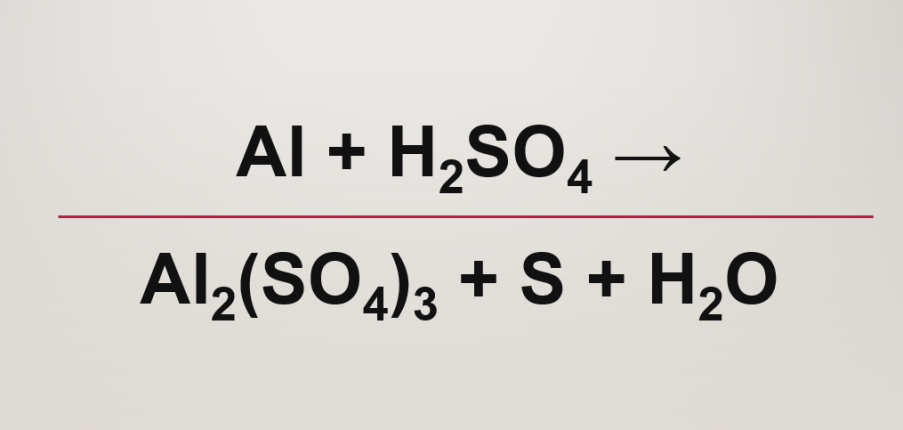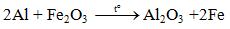Phản ứng Al + H2SO4 → Al2(SO4)3 + S + H2O
1. Phương trình phản ứng Al tác dụng H2SO4 đặc
2Al + 4H2SO4 → Al2(SO4)3 + S + 4H2O
2. Điều kiện phản ứng Al tác dụng H2SO4 đặc xảy ra
Nhiệt độ thường
3. Cân bằng phản ứng Al + H2SO4 → Al2(SO4)3 + S + H2O bằng phương pháp thăng bằng electron
Al0 + H2S+6O4 → Al+32(SO4)3 + S0 + H2O
|
2x 1x |
Al0 → Al+3 + 3e S+6 + 6e → S0 |
Phương trình hóa học
2Al + 4H2SO4 → Al2(SO4)3 + S + 4H2O
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Al (Nhôm)
- Trong phản ứng trên Al là chất khử.
- Al tác dụng với các axit có tính oxi hoá mạnh như dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng. (Chú ý: Al bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội)
4.2. Bản chất của H2SO4 đặc nóng (Axit sunfuric)
- Trong phản ứng trên H2SO4 là chất oxi hoá.
- Trong H2SO4 thì S có mức oxi hoá +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hoá mạnh.
5. Tính chất hoá học của Al
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
5.1. Tác dụng với phi kim
Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
Tác dụng với phi kim khác
5.2. Tác dụng với axit
Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
5.3. Tác dụng với oxit kim loại (Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
5.4. Tác dụng với nước
Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
5.5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
5.6. Tác dụng với dung dịch muối
Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
6. Tính chất hoá học của H2SO4
6.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
6.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
7. Câu hỏi vận dụng liên quan
Câu 1. Cách nào sau đây không phá hủy các đồ dùng làm bằng nhôm?
A. Dùng nước chanh làm sạch bề mặt nhôm
B. Rửa sạch, lau khô và để chỗ khô ráo
C. Dùng đồ làm bằng nhôm để đựng nước vôi
D. Dùng đồ làm bằng nhôm để đựng nước biển
Lời giải:
Cách không phá hủy các đồ dùng làm bằng nhôm là: Rửa sạch, lau khô và để chỗ khô ráo
Câu 2. Sự khác biệt nhất trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
A. Tác dụng được với oxit bazơ
B. Tác dụng được với bazơ
C. Tác dụng được với muối
D. Khả năng hút nước mạnh (tính háo nước)
Lời giải:
Axit sunfuric đặc có những tính chất hóa học riêng so với H2SO4 loãng
+ Tác dụng với hầu hết kim loại (trừ Au và Pt)
+ Tính háo nước
Câu 3. Nhôm không phản ứng được với dung dịch nào dưới đây?
A. FeSO4
B. HCl loãng, dư
C. H2SO4 đặc, nguội
D. NaOH
Lời giải:
Nhôm bị thụ động trong axit HNO3, H2SO4 đặc nguội
Câu 4. Để phân biệt 3 gói bột: Fe, Cu và Al có thể dùng các dung dịch
A. NaOH và FeCl2
B. HCl và CuCl2
C. Ca(OH)2 và NaCl
D. HCl và NaOH
Lời giải:
Trích mẫu thử và đánh số thứ tự
Cho các mẫu thử vào dd NaOH
+ Mẫu thử phản ứng có khí thoát ra là Al
Al + NaOH + H2O → NaAlO2+ 32H2↑
+ Mẫu thử không phản ứng là Fe và Cu
Để phân biệt Fe và Cu ta cho 2 mẫu thử vào dung dịch HCl
+ Mẫu thử phản ứng có khí thoát ra là Fe
Fe + 2HCl → FeCl2 + H2
Câu 5. Các đồ vật bằng nhôm bền trong không khí và nước là do:
A. Có một lớp Al(OH)3 bên ngoài bảo vệ
B. Có một lớp Al2O3 bên ngoài bảo vệ
C. Nhôm không tan trong nước
D. Nhôm bền, không bị oxi hóa
Lời giải:
Đồ vật làm bằng nhôm bền trong không khí và nước là do có màng oxit Al2O3 bền vững bảo vệ.
Xem thêm các phương trình hóa học khác:
Al + HNO3 → Al(NO3)3 + N2 + H2O | Al ra Al(NO3)3
Al + H2O → Al(OH)3↓ + H2↑ | Al ra Al(OH)3
Al + H2SO4 → Al2(SO4)3 + H2 | Al ra Al2(SO4)3
Al + H2O + NaOH → NaAlO2 + H2 | Al ra NaAlO2
Al + H2SO4 (đặc,nóng) → Al2(SO4)3 + SO2 ↑ + H2O | Al + H2SO4 ra SO2