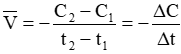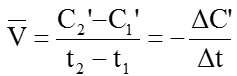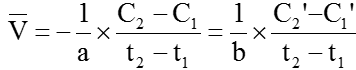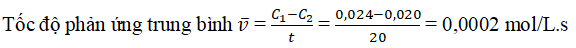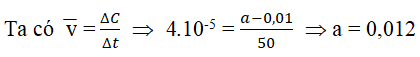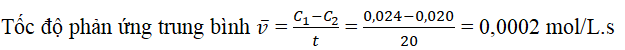Tốc độ phản ứng hóa học - Hóa 10
Lý thuyết
1. Tốc độ phản ứng
- Tốc độ phản ứng là độ biến thiên nồng độ của một chất trong các phản ứng hoặc sản phẩm trong một đơn vị thời gian. Trong đó theo quy ước: nồng độ theo mol/lít, thời gian có thể là giây (s), phút (ph), giờ (h)... Tốc độ phản ứng được xác định bằng thực nghiệm.
2. Tốc độ trung bình
- Tốc độ trung bình của phản ứng hóa học là tốc độ biến thiên trung bình nồng độ của một chất trong khoảng thới gian t1 đến t2.
Ví dụ: Xét phản ứng aA → bB
Nếu tính tốc độ phản ứng theo chất A: Ở thời điểm t1 chất A có nồng độ C1 mol/lít, ở thời điểm t2 chất A có nồng độ C2 mol/lít. Tốc độ trung bình của phản ứng là:
Còn nếu tính tốc độ phản ứng theo chất B thì tốc độ trung bình của phản ứng là:
Để tốc độ phản ứng là đơn giá trị người ta sử dụng biểu thức:
3. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Khi tăng nồng độ của chất phản ứng thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất khí tham gia, khi tăng áp suất thì tốc độ phản ứng tăng.
- Khi tăng nhiệt độ thì tốc độ phản ứng tăng.
- Đối với các phản ứng hóa học có chất rắn tham gia thì khi tăng diện tích bề mặt, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng không tiêu hao trong quá trình phản ứng.
- Chất ức chế phản ứng là chất làm giảm tốc độ phản ứng, nhưng không bị tiêu hao trong quá trình phản ứng.
4. Ý nghĩa thực tiễn của tốc độ phản ứng
- Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng nhiều trong đời sống và sản xuất.
Ví dụ: Thực phẩm nấu trong nồi áp suất nhanh chín hơn khi nấu áp suất thường.
- Các chất đốt như than, củi cháy nhanh hơn khi có kích thước nhỏ.
Phương pháp giải
Ví dụ minh họa
Ví dụ 1: Cho phản ứng: X(khí) + Y(khí) → Z(khí) + T(khí)
Nếu tăng nồng độ chất Y lên 4 lần và nồng độ chất X giảm đi 2 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
Lời giải:
Vban đầu = k.[X].[Y]2=kab2 (với a, b là nồng độ chất X, Y).
Vsau = =8.kab2
Vậy tốc độ tăng lên 8 lần
Ví dụ 2. Cho phản ứng: 2X(khí) + Y(khí) → Z(khí) + T(khí)
Nếu áp suất của hệ tăng 3 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
Lời giải:
Vban đầu = k.[X] 2.[Y] = kx2y ( với x, y là nồng độ của X, Y)
Khi áp suất của hệ tăng 3 lần thì nồng độ các chất cũng tăng gấp 3 lần .
⇒ Vsau= k.[3X] 2.[3Y]= k(3x) 2 .(3y)=27kx2y
Vậy tốc độ phản ứng tăng lên 27 lần
Ví dụ 3. Tốc độ của phản ứng tăng bao nhiêu lần nếu tăng nhiệt độ từ 200oC đến 240oC, biết rằng khi tăng 10oC thì tốc độ phản ứng tăng 2 lần.
Lời giải:
Gọi V200 là tốc độ phản ứng ở 200oC
Ta có: V210= 2.V200
V220= 2V210=4V200
V230=2V220=8V200
V240=2V230=16V200
Vậy tốc độ phản ứng tăng lên 16 lần
Ví dụ 4. Cho phản ứng: A+ 2B → C
Nồng độ ban đầu các chất: [A] = 0,3M; [B] = 0,5M. Hằng số tốc độ k = 0,4
a) Tính tốc độ phản ứng lúc ban đầu.
b) Tĩnh tốc độ phản ứng tại thời điểm t khi nồng độ A giảm 0,1 mol/l.
Lời giải:
a) Tốc độ ban đầu:
Vban đầu = k.[A].[B]2= 0,4.[0,3].[0,5] 2 =0,3 mol/ls
b) Tốc độ tại thời điểm t
Khi nồng độ A giảm 0,1 mol/lít thì B giảm 0,2 mol/l theo phản ứng tỉ lệ 1 : 2
Nồng độ tại thời điểm t:
[A’] = 0,3 – 0,1 =0,2 (mol/l)
[B’]=0,5 -0,2 =0,3 (mol/l)
V= k.[A’].[B’] 2= 0,4.[0,2].[0,3] 2=0,0072 mol/ls
Bài tập vận dụng (có đáp án)
1. Trắc nghiệm
Câu 1: Tốc độ phản ứng của chất khí sẽ giảm khi:
A. Tăng nồng độ chất tham gia
B. Giảm áp suất của chất khí
C. Tăng nhiệt độ
D. Thêm chất xúc tác.
Lời giải:
Đáp án B
Câu 2: Tốc độ phản ứng cho biết:
A. Độ biến thiên nồng độ các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian
B. Mức độ xảy ra nhanh hay chậm của phản ứng hóa học
C. Ảnh hưởng của nhiệt độ, áp suất đến phản ứng hóa học
D. Tổng số độ biến thiên nhanh hay chậm của phản ứng hóa học.
Lời giải:
Đáp án A
Câu 3: Đối với phản ứng phân hủy H2O2 trong nước, khi thay đổi yếu tố nào sau đây, tốc độ phản ứng không thay đổi?
A. Thêm MnO2
B. Tăng nồng độ H2O2
C. Đun nóng
D. Tăng áp suất H2
Lời giải:
Đáp án D
Câu 4: Người ta sử dụng các biện pháp sau để tăng tốc độ phản ứng:
Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống.
Nghiền nguyên liệu trước khi nung để sản xuất clanhke.
Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Trong các biện pháp trên, có bao nhiêu biện pháp đúng?
A. 1 B. 2 C. 3 D. 4
Lời giải:
Đáp án D
Câu 5: Cho cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇋ 2SO3 (k) ; ΔH< 0
Cho các biện pháp:
Tăng nhiệt độ;
Tăng áp suất chung của hệ phản ứng;
Hạ nhiệt độ;
Dùng thêm chất xúc tác V2O5;
Giảm nồng độ SO3;
Giảm áp suất chung của hệ phản ứng.
Trong các biện pháp trên, những biện pháp nào làm cân bằng chuyển dịch theo chiều thuận?
A. (1), (2), (4), (5)
B. (2), (3), (5)
C. (2), (3), (4), (6)
D. (1), (2), (5)
Lời giải:
Đáp án B
Câu 6: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10-4mol/(l.s)
B. 5,0.10-4mol/(l.s)
C. 1,0.10-3mol/(l.s)
D. 5,0.10-4mol/(l.s)
Lời giải:
Đáp án D
Câu 7: Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol. Sau 20 giây phản ứng, nồng độ của chất đó là 0,020 mol. Hãy tính tốc độ trung bình của phản ứng này trong thời gian đã cho.
Lời giải:
Câu 8. Nồng độ ban đầu của A2 và B2 là 0,03 mol/l. Khi phản ứng:
A2(k) + B2(k) ⇋ 2AB(k);
Khi đạt trạng thái cân bằng, nồng độ của AB là 0,04 mol/l. Hằng số cân bằng của phản ứng trên là:
A. 9 B. 16 C. 32 D. 64
Lời giải:
A2 (k) + B2 (k) ⇋ 2AB (k)
0,02 0,02 0,04
K = 0,042/ (0,01.0,01) = 16
Đáp án B
2. Tự luận
Câu 1. Cho phản ứng A + 2B → C
Cho biết nồng độ ban đầu của A là 0,8M, của B là 0,9M và hằng số tốc độ k = 0,3. Hãy tính tốc độ phản ứng khi nồng độ chất A giảm 0,2M.
Lời giải:
Ta có [A] giảm 0,2M thì theo phương trình:
A + 2B → C
0,2 → 0,4 → 0,2
⇒ [B] giảm 0,4
Nồng độ còn lại của các chất: [A] = 0,8 – 0,2 = 0,6M
[B] = 0,9 – 0,4 = 0,5M
Tốc độ phản ứng: v = k.[A].[B]2 = 0,3 x 0,6 x (0,5)2 = 0,045
Câu 2. Cho phản ứng hóa học có dạng: A + B → C.
Tốc độ phản ứng thay đổi như thế nào khi:
a. Nồng độ A tăng 2 lần, giữ nguyên nồng độ B.
b. Nồng độ B tăng 2 lần, giữ nguyên nồng độ A.
c. Nồng độ của cả hai chất đều tăng lên 2 lần.
d. Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần.
e. Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí
Lời giải:
Ta có: v = k.[A].[B]
a, Khi [A] tăng 2 lần thì : va = k.[2A].[B] = 2k.[A].[B] = 2v
Vậy tốc độ phản ứng tăng lên 2 lần.
b, Khi [B] tăng lên 2 lần thì : vb = k.[2B].[A] = 2k.[A].[B] = 2v
Vậy tốc độ phản ứng tăng lên 2 lần.
c, Khi [A] và [B] đều tăng 2 lần: vc = k.[2A].[2B] = 4k.[A].[B] = av
Vậy tốc độ phản ứng tăng lên 4 lần.
d, Nồng độ của chất này tằng 2 lần, nồng độ của chất kia giảm 2 lần, do đó tốc độ phản ứng không thay đổi.
e, Khi tăng áp suất 2 lần (tương ứng với việc giảm thể tích 2 lần) nghĩa là tăng nồng độ của mỗi phản ứng lên 2 lần, do đó tốc độ phản ứng tăng lên 4 lần
Câu 3. Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol/l. Sau 10s xảy ra phản ứng nồng độ của chất đó là 0,022 mol/lít. Hãy tính tốc độ phản ứng trong thời gian đó
Lời giải:
Tốc độ phản ứng: v = (0,024-0,022)/10 = 0,0002 (mol/lít.s)
Câu 4. Cho phản ứng Br2 + HCOOH → 2HBr + CO2
Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.104 mol (l.s). Tính giá trị của a.
Lời giải:
Câu 5. Cho chất xúc tác Mn2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tính tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây.
Lời giải:
Câu 6. Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol. Sau 20 giây phản ứng, nồng độ của chất đó là 0,020 mol. Hãy tính tốc độ trung bình của phản ứng này trong thời gian đã cho.
Lời giải:
Câu 7. Cho phản ứng hóa học: H2(k) + I2(k) ⇋ 2HI(k)
Công thức tính tốc độ của phản ứng trên là v = k [H2] [I2]. Tốc độ của phản ứng hoa học trên sẽ tăng bao nhiêu lần khi tăng áp suất chung của hệ lên 3 lần?
Lời giải:
v = k[3H2][3I2] = 9.K.[H2].[I2]. Như vậy tốc độ phản ứng tăng 9 lần.
Câu 8. Cho phản ứng hóa học: 2NO(k) + O2(k) → 2NO2(k)
Tốc độ phản ứng hóa học trên được tính theo công thức y = k [NO]2[O2]. Hỏi ở nhiệt độ không đổi, áp suất chung của hệ đã tăng bao nhiêu lần khi tốc độ của phản ứng tăng 64 lần?
Lời giải:
Đặt x là số lần tăng của áp suất. Theo bài ra ta có v2/v1 = 64 = x3 → x = 4.
Bài tập tự luyện
Câu 1: Cho phương trình hóa học của phản ứng:
X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
A. 4,0.10-4mol/(l.s). B. 7,5.10-4mol/(l.s).
C. 1,0.10-4mol/(l.s). D. 5,0.10-4mol/(l.s).
Câu 2: Cho cân bằng hóa học:
N2 (k) + 3H2 (k) ⇋ 2NH3 (k)
Phản ứng thuận là phản ứng toả nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
A. Thay đổi áp suất của hệ B. Thay đổi nồng độ N2
C. Thay đổi nhiệt độ D. Thêm chất xúc tác Fe.
Câu 3: Xét cân bằng:
N2O4 (k) ⇋ 2NO2 (k) ở 25oC.
Khi chuyển dich sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2.
A. Tăng 9 lần B. Tăng 3 lần
C. Tăng 4,5 lần D. Giảm 3 lần.
Câu 4: Cho phương trình hoá học của phản ứng tổng hợp amoniac.
N2(k) + 3H2(k) 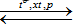
Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận.
A. giảm đi 2 lần.
B. tăng lên 2 lần.
C. tăng lên 8 lần.
D. tăng lên 6 lần.
Câu 5: Thực hiện phản ứng sau trong bình kín. H2(k) + Br2(k) → 2HBr (k)
Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là.
A. 8.10-4 mol/(l.s)
B. 6.10-4 mol/(l.s)
C. 4.10-4 mol/(l.s)
D. 2.10-4 mol/(l.s)
Câu 6: Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng. mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. t3
B. t1
C. t1=t2=t3
D. t2
Câu 7: Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC). Trường hợp nào tốc độ phản ứng không đổi ?
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
B. Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M.
C. Tăng nhiệt độ phản ứng từ 25oC đến 50oC.
D. Thêm chất xúc tác.
Câu 8: Cho Fe (hạt) phản ứng với dung dịch HCl 1M. Thay đổi các yếu tố sau.
(1) Thêm vào hệ một lượng nhỏ dung dịch CuSO4.
(2) Thêm dung dịch HCl 1M lên thể tích gấp đôi.
(3) Nghiền nhỏ hạt sắt thành bột sắt.
(4) Pha loãng dung dịch HCl bằng nước cất lên thể tích gấp đôi.
Có bao nhiêu cách thay đổi tốc độ phản ứng?
A. 1.
B. 4.
C. 3.
D. 2.
Xem thêm các dạng bài tập Hóa học 10 chi tiết và hay khác:
50 Bài tập thành phần của nguyên tử (có đáp án năm 2023) - Hóa 10
50 Bài tập về nguyên tố hóa học (có đáp án năm 2023) - Hóa 10
50 Bài tập về cấu trúc lớp vỏ electron nguyên tử (có đáp án năm 2023) - Hóa 10
50 Bài tập Hóa 10 Cấu tạo nguyên tử (có đáp án năm 2023)
50 Bài tập về cấu trúc lớp vỏ electron nguyên tử (có đáp án năm 2023) - Hóa 10