Kiến thức cần nhớ
I. Nguyên tố hóa học
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số electron ở vỏ nguyên tử. Các electron trong nguyên tử quyết định tính chất hóa học của nguyên tử, nên các nguyên tử của cùng một nguyên tố hóa học có tính chất hóa học giống nhau.
Ví dụ 1: Tất cả nguyên tử có cùng số đơn vị điện tích hạt nhân là 6 đều thuộc nguyên tố carbon dù chúng có thể có số neutron khác nhau.
Ví dụ 2: Cho các nguyên tử sau: B (Z = 8, A = 16), D (Z = 7, A = 14), E (Z = 9, A = 19), F (Z = 8, A = 18).
Trong các nguyên tử trên, nguyên tử B và F thuộc cùng một nguyên tố hóa học vì có cùng số đơn vị điện tích hạt nhân (Z = 8).
II. Kí hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z) của nguyên tố đó) và số khối (A) là những đặc trưng cơ bản của một nguyên tử.
Khi viết kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở phía dưới và số khối A ở phía trên.
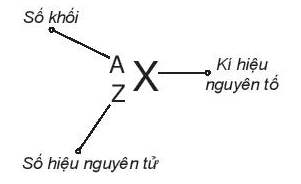
Ví dụ 1: Kí hiệu nguyên tử helium là H42e. Cho biết:
+ Nguyên tử helium có kí hiệu là He.
+ Số hiệu nguyên tử helium là Z = 2 = số proton = số electron.
+ Số khối của nguyên tử helium là A = 4.
A = Z + N → Số neutron = N = A – Z = 4 – 2 = 2.
Ví dụ 2: Nguyên tử nitrogen có 7 proton và 7 neutron.
Ta có:
+ Số hiệu nguyên tử Z = số proton = 7.
+ Số khối của nguyên tử nitrogen là A = Z + N = 7 + 7 = 14.
→Kí hiệu nguyên tử nitrogen là N147.
III. Đồng vị
Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
Ví dụ 1: Mô hình cấu tạo nguyên tử các đồng vị của nguyên tố hydrogen.
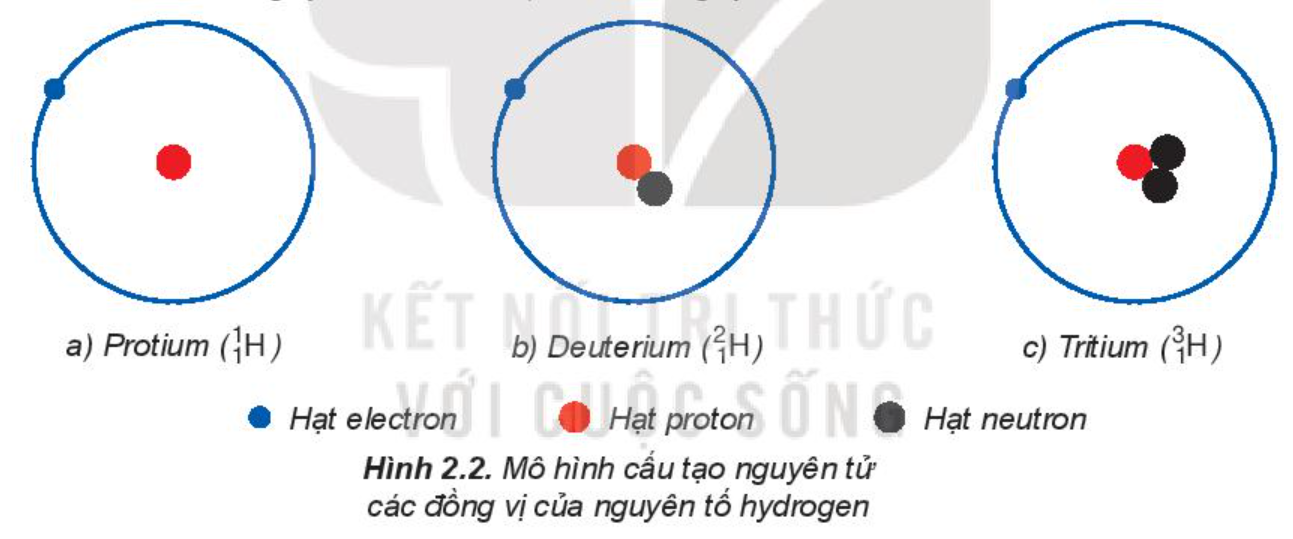 Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
Ví dụ 2: Ở dạng đơn chất, đồng vị C3717l có tỉ khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị C3517l.
IV. Nguyên tử khối
1. Nguyên tử khối
Nguyên tử khối là khối lượng của nguyên tử, cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử. Do khối lượng proton và neutron đều xấp xỉ 1,0 amu, còn khối lượng electron nhỏ hơn rất nhiều (0,00055 amu), nên có thể coi khối lượng nguyên tử xấp xỉ số khối.
Ví dụ: Nguyên tử của nguyên tố potassium có 19 proton và 20 neutron.
Nguyên tử khối của potassium là A = 19 + 20 = 39.
2. Nguyên tử khối trung bình
Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu ˉA) của hỗn hợp các đồng vị của nguyên tố đó.
Biểu thức tổng quát tính nguyên tử khối trung bình (ˉA): ˉA=(X.a)+(Y.b)+...100
Trong đó, ˉA là nguyên tử khối trung bình; X và Y, … lần lượt là nguyên tử khối của các đồng vị X và Y, …; a và b, … lần lượt là % số nguyên tử của các đồng vị X và Y, …
Ví dụ 1: Trong tự nhiên, nguyên tố chlorine có hai đồng vị bền là C3517l (chiếm 75,77%) và C3717l (chiếm 24,23% số nguyên tử).
Nguyên tử khối trung bình của chlorine:ˉA=(75,77.35)+(24,23.37)100=35,48 .
Ví dụ 2: Nguyên tử khối trung bình của copper bằng 63,546. Copper tồn tại trong tự nhiên dưới hai dạng đồng vị C6329u và C6529u . Tính phần trăm số nguyên tử của đồng vị C6329u tồn tại trong tự nhiên.
Hướng dẫn:
Gọi phần trăm số nguyên tử của đồng vị C6329u và C6529u lần lượt là x (%) và y (%).
Ta có: x + y = 100 (*).
Nguyên tử khối trung bình của copper: ˉA=63x+65y100=63,546 (**).
Từ (*) và (**), suy ra: x = 72,7 và y = 27,3.
Các dạng bài tập về nguyên tố hóa học
Dạng 1: Tính nguyên tử khối trung bình.
- Nếu chưa có số khối A1; A2. ta tìm A1 = p + n1; A2 = p+ n2; A3 = p + n3
- Áp dụng công thức :
![]()
trong đó A1, A2, A3 là số khối của các đồng vị 1, 2, 3
x1, x2, x3 là % số nguyên tử của các đồng vị 1, 2, 3
hoặc 
trong đó A1, A2, A3 là số khối của các đồng vị 1, 2, 3
x1, x2, x3 là số nguyên tử của các đồng vị 1, 2, 3
Dạng 2: Xác định phần trăm các đồng vị
- Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Loại 1. Tính % khối lượng của một đồng vị trong phân tử
1. Phương pháp giải
Hầu hết các nguyên tố có mặt trong tự nhiên là hỗn hợp các đồng vị bền
Áp dụng công thức:
- Trong đó A1, A2, A3,… là số khối của các đồng vị.
- x1,x2,x3,… là thành phần % của các đồng vị.
Sử dụng sơ đồ đường chéo:
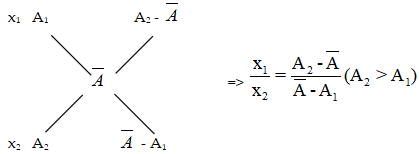
2. Ví dụ minh họa
Ví dụ 1: Trong tự nhiên nguyên tố Brom có 2 đồng vị, trong đó đồng vị chiếm 54,5% về số lượng. Số khối của đồng vị còn lại là?
Đáp án hướng dẫn giải bài tập
Đặt A2 là số khối của đồng vị thứ hai.
Phần trăm số lương của nó là: 100 - 54,5 = 45,5
Ta có:
Loại 2. Tính số nguyên tử của đồng vị trong một lượng chất
1. Ví dụ minh họa
Ví dụ 2: Khối lượng nguyên tử trung bình cả Bo (B) là 10,812u. Số nguyên tử khi có 94 nguyên tử là bao nhiêu?
Đáp án hướng dẫn giải bài tập
Suy ra phần trăm số lượng của là: 100% - 18,8% = 81,2%
Do đó, số nguyên tử khi có 94 nguyên tử là:
94.81,2/18,8 = 406 nguyên tử
Dạng 3: Xác định số khối của các đồng vị
- Gọi số khối các đồng vị 1, 2 lần lượt là A1; A2.
- Lập hệ 2 phương trình chứa ẩn A1; A2 Þ giải hệ được A1; A2.
Bài tập tự luyện
1. Bài tập vận dụng
Bài 1. Cho các nguyên tử có kí hiệu là các chữ cái và số proton như sau:
5A; 8B; 17C; 6D; 8E;17F; 17H
Các nguyên tử sau thuộc cùng một nguyên tố hóa học là:
A: A, B, C, D
B: D, E, F, H
C: B, E
D: C, F, H
E: C và D
Hãy chọn phương án đúng.
Bài 2. Nhận xét sau có 2 ý:
“Những nguyên tử cùng loại thì có cùng số proton trong hạt nhân và chúng thuộc cùng một nguyên tố hóa học”
Hãy chọn phương án đúng trong các phương án sau:
A. Ý (I) đúng, ý (II) sai.
B. Ý (I) sai, ý (II) đúng.
C. Cả hai ý đều đúng.
D. Cả hai ý đều sai.
Bài 3. Tính khối lượng bằng gam của:
1. Nguyên tử nhôm
2. Nguyên tử photpho
3. Nguyên tử oxi.
Bài 4. Hãy so sánh xem nguyên tử O nặng hơn hay nhẹ hơn nguyen tử H, S, C bao nhiêu lần?
Bài 5. Dùng chữ số và kí hiệu để biểu diễn: năm nguyên tử hiđro, bảy nguyên tử kali, sáu nguyên tử lưu huỳnh.
Bài 6. Nguyên tử X nặng gấp 2 lần nguyên tử lưu huỳnh. Tính khối lượng nguyên tử X viết KHHH của X.
Bài 7. Nguyên tử X nặng bằng 1/ 2 nguyên tử Y và nguyên tử Y nặng bằng 1,5 nguyên tử khối của Z.
1. Tính nguyên tử khối của X.
2. Viết KHHH của X và Y. Biết Z là nguyên tố oxi.
2. Bài tập tự luyện có hướng dẫn
Câu 1. Khối lượng nguyên tử của B bằng 10,81. B trong tự nhiên gồm hai đồng vị 10B và 11B. Hỏi có bao nhiêu phần trăm 11B trong axit boric H3BO3. Cho H3BO3 = 61,81.
Đáp án hướng dẫn giải bài tập
Giả sử % của 10B và 11B trong tự nhiên lần lượt là x, y.
Ta có hệ phương trình:
Câu 2. Trong tự nhiên đồng vị 37Cl chiếm 24,23,% số nguyên tử clo. Tính thành phần phần trăm về khối lượng 37Cl có trong HClO4 (với hidro là đồng vị 1H, oxi là đồng vị 16O). Cho khối lượng nguyên tử trung bình của Clo là 35,5
Đáp án hướng dẫn giải bài tập
Đặt số mol HClO4 là 1 mol thì có 0,2423 mol 37Cl
Câu 3. Trong tự nhiên Brom có 2 đồng vị là 79Br và 81Br có nguyên tử khối trung bình là 79,92. Thành phần phần trăm về khối lượng của 81Br trong NaBr là bao nhiêu. Cho MNa = 23
Đáp án hướng dẫn giải bài tập
Gọi phần trằm đồng vị 79Br là a%
=> Phần trăm của đồng vị 81Br là 100% - a%
Nguyên tử khối trung bình của Br:
Câu 4. Cho hợp chất XY2 tạo bởi hai nguyên tố X, Y. Y có hai đồng vị 79Y: chiếm 55% số nguyên tử Y và đồng vị 81Y. Trong XY2, phần trăm khối lượng của X là bằng 28,51%. Tính nguyên tử khối trung bình của X, Y.
Đáp án hướng dẫn giải bài tập
X = 63,73
Y = 79,
Giải thích các bước giải:
Phần trăm số nguyên tử của 81Y = 100%−55% = 45%
Suy ra, nguyên tử khối trung bình của Y là :
= 79.55% + 81.45% = 79,9
Ta có :
% X= (X/X+2Y).100% = (X/X+79,9.2).100%= 28,51%
⇒ X = 63,73
Câu 5. Trong tự nhiên Cu có 2 đồng vị là là 63Cu và 65Cu. Khối lượng nguyên tử trung bình của Cu là 63,54. Thành phần phần trăm về khối lượng của là 63Cu trong CuCl2 là bao nhiêu (biết M Cl = 35,5)
Đáp án hướng dẫn giải bài tập
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y
Ta có hệ phương trình
Phần trăm khối lượng của 63Cu trong CuCl2 là:
Câu 6. Trong tự nhiên clo có hai đồng vị bền là 37Cl và 35Cl. Tính thành phần phần trăm về khối lượng 37Cl có trong KClO3 (với kiện là đồng vị 39K, oxi là đồng vị 16O). Cho khối lượng nguyên tử trung bình của Clo là 35,5.
Đáp án hướng dẫn giải bài tập
Giả sử % nguyên tử 35Cl và 37Cl trong tự nhiên lần lượt là x, y.
Phần trăm khối lượng của 37Cl trong KClO3 là:
Câu 7. Cacbon có hai đồng vị bền là 126C và 136C, và ![]() . Tính % khối lượng của trong hợp chất CO2 (cho MNa = 23; MO = 16)
. Tính % khối lượng của trong hợp chất CO2 (cho MNa = 23; MO = 16)
Đáp án hướng dẫn giải bài tập
Gọi % số nguyên tử của đvị 12C và 13C lần lượt là x và y
Ta có hệ:
Xét 1 mol CO2 1 mol C => mC = 12,01
2 mol O => mO = 32
Ta biết % số nguyên tử = % số mol nên
Số mol của 12C là: 0,99.1 = 0,99 mol
%m12C = (0,99.12.100)/(12,01+ 32) = 27
Câu 9. Nguyên tố Bạc có 2 đồng vị trong tự nhiên là 107Ag chiếm 51,839% số nguyên tử. Tính số khối của đồng vị còn lại biết trong AgCl bạc chiếm 75,254% về khố lượng. Cho Cl = 35,5
Đáp án hướng dẫn giải bài tập
Gọi nguyên tử khối của bình của Ag là M.
→%mAg =M/(M+ 35,5) = 75,254%
→M = 107,9575
Gọi số khối của đồng vị còn lại là x, đồng vị này chiếm 48,161%
→ 107.51,839% + x.48,161% = 107,9575 → x = 109
Đáp số: 109
Câu 10. Trong tự nhiên, X có hai đồng vị 35X và 37X, chiếm lần lượt 75,77% và 24,23% số nguyên tử X. Y có hai đông vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y.
a) Trong tự nhiên có bao nhiêu loại phân tử XY?
b) Phân tử khối trung bình của XY là
Đáp án hướng dẫn giải bài tập
X có hai đồng vị 35X và 37X
=>
Đây là Cl
Y có hai đồng vị 1Y và 2Y
=>
=> Đây là H
1 nguyên tử H gắn với 1 nguyên tử Cl
+ Số cách chọn nguyên tử Cl ứng với 2 cách chọn tương đương 2 đồng vị
+ Số cách chọn nguyên tử H: 2 cách chọn tương đương 2 đồng vị
=> có 2.2 = 4 cách chọn
Câu 11. Nguyên tố clo có hai đồng vị bền 35Cl chiếm 75,77% và 37Cl chiếm 24,23%. Tính nguyên tử khối trung của clo?
Đáp án hướng dẫn giải bài tập
Áp dụng công thức tính nguyên tử khối trung bình:
Trong đó đồng vị A có x% số nguyên tử, đồng vị B có y% số nguyên tử.
Vậy nguyên tử khối trung bình của nguyên tố clo bằng:
Đáp số: 35,5
Câu 12. Trong tự nhiên có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl. Thành phần % theo khối lượng của 37Cl trong HClO4 là:
Đáp án hướng dẫn giải bài tập
%35Cl = 100% - 24,23% = 75,77%
→ MCl = 37 x 0,2423 + 35 x 0,7577 = 35,4846.
→ Thành phần % của 37Cl trong HClO4 là
Câu 13. Trong tự nhiên Cu có 2 đồng vị là 63Cu và 65Cu. Nguyên tử trung bình của Cu là 63,546. Số nguyên tử 63Cu có trong 31,773g Cu là bao nhiêu?
Đáp án hướng dẫn giải bài tập
Giả sử % của 63Cu và 65Cu trong tự nhiên lần lượt là x, y.
Ta có hệ phương trình:
Câu 14. Trong tự nhiên Clo có 2 đồng vị là 35Cl và 37Cl có nguyên tử khối trung bình là 35,5. Tính số nguyên tử của đồng vị 37Cl, trong 3,65 g HCl (cho khối lượng mol của H = 1).
Đáp án hướng dẫn giải bài tập
Ta có tỉ lệ nguyên tử 35Cl:37Cl = 1,5:0,5 = 3:1
nHCl = 0,1 => nCl = 0,1
Số mol 37Cl = 0,1.1/(1+3) = 0,025
=> Số nguyên tử 37Cl = 0,025.6,02.1023
Số nguyên tử 37Cl = 0,025.6,02.1023 = 1,505.1022
Câu 15. Hidro có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 2H trong 9 gam nước (cho rằng trong nước chỉ có đồng vị 1H và 2H, cho MH2O = 18).
Đáp án hướng dẫn giải bài tập
1ml có khối lượng là 1gam. Số mol H2O = 1/18 = 0,056 mol
H2O -> 2H + O
Nên số mol H = 2.0056 = 0,112 mol. Số nguyên tử H là 0,122.6,023.1023
= 674576.1017
Gọi a, b tương ứng là tỉ lệ % của 1H và 2H
Ta có: a + 2b = 1,008
a + b = 1 => b = 0,008 (0,8%) =>a = (99,2%)
Câu 16. Hidro có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị 2H trong 1 ml nước (cho rằng trong nước chỉ có đồng vị 1H và 2H, cho MH2O = 18).
Đáp án hướng dẫn giải bài tập
Gọi % đồng vị là a: => a = 0,8; % là 0,8%
m của 1ml H2O: 1 gam
MH2O = 16 + 2,016 = 18,016u
—> Khối lượng của 1 mol H2O là 18,016g.
Số nguyên tử H có trong 1ml H2O
nguyên tử = 666.1020 nguyên tử
Số nguyên tử chiếm:
nguyên tử.
Câu 17. Cho 2 đồng vị hiđro với tỉ lệ % số nguyên tử: ![]() . Hãy tính số nguyên tử trong 2,24 lít khí H2. Biết nguyên tử khối trung bình của hiđro là 1,001.
. Hãy tính số nguyên tử trong 2,24 lít khí H2. Biết nguyên tử khối trung bình của hiđro là 1,001.
Đáp án hướng dẫn giải bài tập
Câu 18. Nguyên tố Magiê có 3 đồng vị khác nhau ứng với số và thành phần % tương ứng như sau: 24Mg ( 78,99%) , 25Mg ( 10%) và 26Mg ( 11.01%). a/ tính nguyên tử khối trung bình Mg b/ Giả sử trong hỗn hợp trên có 25 nguyên tử 25Mg thì số nguyên tử tương ứng của 2 đồng vị còn lại là bao nhiêu?
Đáp án hướng dẫn giải bài tập
Ta có:
A = 78,99%.24 + 10%.25 + 11,01%.26 = 24,3202
Mà %Mg = 10%
Theo bài ra: N25Mg=25
⇒∑N= 25/10% =250
Vậy: Số nguyên tử: N24Mg= 250.78,99%≈197
Số nguyên tử N26Mg= 250.11,01% ≈ 27
Câu 19. Tổng số các hạt cơ bản (p, n, e) của một nguyên tử X là 28. Số hạt mang điện nhiều hơn số hạt không mang điện là 8. Xác định ký hiệu và tên nguyên tử X.
Đáp án hướng dẫn giải bài tập
Tổng số các hạt cơ bản (p, n, e) của một nguyên tử X là 28
=> n + p + e = 28 => 2p + n = 28 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 8
=> p + e – n = 8 => 2p – n = 8 (2)
Từ (1) và (2) => p = 9, n = 10
p = 9 => X là F
=> AF = p + n = 9 + 10 = 19
Ký hiệu nguyên tử của F là:
Câu 20. Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. Xác định tên của R và các định số khối của R
Đáp án hướng dẫn giải bài tập
Trong R, tổng số hạt mang điện và không mang điện là 34
=> p + n + e = 34 => 2p + n = 34 (1)
Mặt khác, số hạt mang điện gấp 1,833 lần số hạt không mang điện
=> p + e = 1,833n => 2p = 1,833n (2)
Từ (1) và (2) => p = 11, n =12
Z = 11 => R là Al
AR = 11 + 12 = 23




