Bài tập mở đầu về hóa học hữu cơ
Kiến thức cần nhớ
Hợp chất hữu cơ và hóa học hữu cơ
1. Khái niệm
- Hợp chất hữu cơ là các hợp chất của cacbon trừ oxit của cacbon, muối cacbua, muối cacbonat, muối xianua…
- Hoá học hữu cơ là ngành hóa học chuyên nghiên cứu các hợp chất hữu cơ.
2. Phân loại hợp chất hữu cơ
- Hợp chất hữu cơ được chia thành hiđrocacbon và dẫn xuất hiđrocacbon.
a/ Hiđrocacbon là loại hợp chất hữu cơ đơn giản nhất, trong thành phần phân tử chỉ chứa hai nguyên tố là cacbon và hiđro. Hiđrocacbon lại được chia thành:
+ Hiđrocacbon no
+ Hiđrocacbon không no
+ Hiđrocacbon thơm.
b/ Dẫn xuất của hiđrocacbon là những hợp chất mà trong phân tử ngoài C, H ra còn có một số hay nhiều nguyên tố khác như O, N, S, halogen...
+ Dẫn xuất halogen: R – X ( R là gốc hiđrocacbon)
+ Hợp chất chứa nhóm chức:
- OH : ancol; - O - : ete; - COOH: axit......
- Ngoài ra, người ta cũng phân loại hợp chất hữu cơ theo mạch cacbon:
+ Hợp chất hữu cơ mạch vòng.
+ Hợp chất hữu cơ mạch hở.
3. Đặc điểm chung
a) Đặc điểm cấu tạo
- Hợp chất hữu cơ nhất thiết phải chứa C, hay có H thường gặp O ngoài ra còn có halogen, N, P...
- Liên kết chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
b) Tính chất vật lí
- Các hợp chất hữu cơ thường dễ bay hơi, dễ cháy, kém bền nhiệt.
- Phần lớn các hợp chất hữu cơ không tan trong nước, tan nhiều trong các dung môi hữu cơ.
c) Tính chất hóa học
- Các hợp chất hữu cơ thường kém bền với nhiệt và dễ cháy.
- Các phản ứng trong hoá học hữu cơ thường chậm, không hoàn toàn, xảy ra theo nhiều hướng thường phải đun nóng và có xúc tác.
Phân tích nguyên tố
Để xác định công thức phân tử hợp chất hữu cơ người ta phải xác định:
- Thành phần định tính nguyên tố.
- Thành phần định lượng nguyên tố.
1. Phân tích định tính
- Mục đích: Phân tích định tính nguyên tố để xác định thành phần các nguyên tố hóa học chứa trong một chất.
- Nguyên tắc: Muốn xác định thành phần các nguyên tố, người ta chuyển các nguyên tố trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản rồi nhận biết các sản phẩm đó bằng các phản ứng đặc trưng.
a. Xác định cacbon và hiđro
- Phương pháp: Trong phòng thí nghiệm, để xác định định tính C và H, người ta nung hợp chất hữu cơ với CuO để chuyển C → CO2, H → H2O.
+ Xác nhận có H: dùng CuSO4 khan để hấp thụ nước.
+ Xác định có C: dẫn khí CO2 qua dung dịch Ca(OH)2.
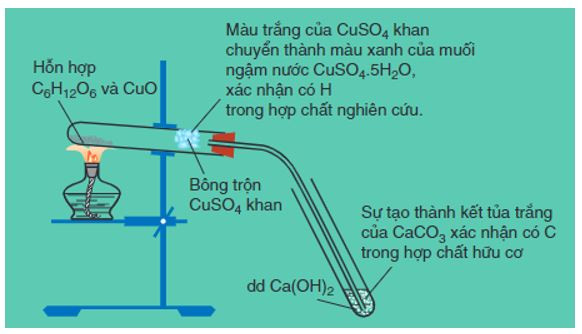
Hình 1: Thí nghiệm xác định định tính C, H có trong glucozơ
b. Xác định nitơ và oxi
- Xác định N: Đốt cháy hợp chất hữu cơ, nếu có mùi khét thì hợp chất đó có nitơ. Hoặc đun hợp chất hữu cơ với H2SO4 đặc (NaOH đặc) có mùi khai NH3 thì hợp chất đó có chứa nitơ.
CxHyOzNt + H2SO4 đặc(NH4)2SO4 + ......
(NH4)2SO4 + 2NaOHNa2SO4 + H2O + NH3↑
- Xác định O: Khó phân tích định tính trực tiếp, thường xác định nhờ định lượng:
mO = mhợp chất – tổng khối lượng các nguyên tố
c. Xác định halogen
Khi đốt cháy hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng HCl, ta dùng dung dịch AgNO3 để nhận biết.
HCl + AgNO3 → AgCl↓ + HNO3
2. Phân tích định lượng các nguyên tố
- Mục đích: Phân tích định lượng các nguyên tố xác định khối lượng của mỗi nguyên tố hóa học chứa trong hợp chất hữu cơ.
- Nguyên tắc: Muốn định lượng nguyên tố, người ta chuyển các nguyên tố trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản, định lượng chúng, từ đó suy ra thành phần % khối lượng từng nguyên tố.
a. Định lượng cacbon và hiđro
Thí dụ: Đốt cháy chất hữu cơ A thu được CO2 và H2O và N2.
b. Định lượng nitơ
c. Định lượng oxi
mO = mA – ( mC + mH + mN ).
3. Thành phần nguyên tố
→ %O = 100% - %C - %H - %N.
Các dạng bài tập về mở đầu về hóa học hữu cơ
Dạng 1: Câu hỏi lí thuyết
Dạng 2: Xác định thành phần phần trăm khối lượng các nguyên tố hóa học trong hợp chất hữu cơ
Phương pháp giải
Bước 1: Tính số mol CO2, H2O, N2 theo các dữ kiện bài toán.
Bước 2: Áp dụng bảo toàn nguyên tố C, H, N:
Bước 3: Tính khối lượng C, H, O, N.
Trong đó:
Bước 4: Tính phần trăm khối lượng của chúng trong hợp chất.
Bài tập tự luyện
Bài 1. Đốt cháy hoàn toàn 0,92 gam hợp chất hữu cơ thu được 1,76 gam CO2 và 1,08 gam H2O. Xác định % khối lượng mỗi nguyên tố trong hợp chất hữu cơ.
Đáp án hướng dẫn giải chi tiết
Bảo toàn nguyên tố "C": nC = nCO2 = 1,76/44 = 0,04 mol
Bảo toàn nguyên tố "H": nH = 2.nH2O = 2.(1,08/18) = 0,12 mol
Bảo toàn khối lượng => mO = mX - mC - mH = 0,92 - 12.0,04 - 0,12 = 0,32 gam
=> %mO = (0,32/0,92).100% = 34,78%
%C = 0,48/0,92 = 52,17%
%H = 0,12 /0,92 =13,04%
Bài 2. Đốt cháy hoàn toàn 7,75 g vitamin C (chứa C, H, O) thu được 11,62 g CO2 và 3,17 g H2O. Xác định % khối lượng mỗi nguyên tố trong phân tử vitamin C.
Đáp án hướng dẫn giải chi tiết
nCO2 =11,62/44 =0,264 mol → nC = 0,264mol
nH2O =3,17/18 = 0,176 mol → nH = 0,352mol
%mC = 0,264.12/7,75.100% = 40,88%
%mH= 0,352/7,75.100% = 4,54%%
mO= 100% − 4,54% − 40,88% = 54,58%
Bài 3. Oxi hoá hoàn toàn 0,6 g hợp chất hữu cơ A thu được 0,672 lít khí CO2 (ở đktc) và 0,72 g H2O. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Đáp án hướng dẫn giải chi tiết
nCO2 = 0,672/22,4 = 0,03 mol
nH2O = 0,72/18 = 0,04 mol
nC = nCO2 = 0,03 mol
nH= 2nH2O= 0,08 mol
%m = 0,03.120,6.100% = 60%
%mH= 0,08.10,6.100% = 13,33%
%mO = 100 − 60 −13,33 = 26,67%
Bài 4. Oxi hoá hoàn toàn 0,135 g hợp chất hữu cơ A rồi cho sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH, thì thấy khối lượng bình 1 tăng lên 0,117 g, bình 2 tăng thêm 0,396 g. Ở thí nghiệm khác, khi nung 1,35 g hợp chất A với CuO thì thu được 112 ml (đktc) khí nitơ. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Đáp án hướng dẫn giải chi tiết
Do khi oxi hóa và khi đốt có CO2, H2O và N2
=> Hợp chất hữu cơ A phải có các nguyên tố C, H, N và có thể có O
=> mbình1tăng = mH2O = 0,117(g)
=> nH2O = 0,117/18 = 0,0065 (mol)
=>nH = 2nH2O = 2.0,0065 = 0,013 (mol)
=>mbình2tăng = mCO2 = 0,39 6 (g)
=> nCO2 = 0,396/44 = 0,009 (mol) => nC = nCO2 = 0,009 (mol)
nN2 = 11,2/1000.22,4 = 0,0005(mol) =>nN = 2nN2 = 0,0005.2 = 0,001 (mol)
=>mA = mC + mH + mN = 0,009.12 + 0,013.1+ 0,001.14 = 0,135 (g)
=> A không có Oxi
=> Đặt công thức hóa học: CxHyNz
=> x:y:z = 0,009:0,013:0,001 = 9:13:1
=> CTHH : C9H13N
Bài 5. Oxi hoá hoàn toàn 0,46 g hợp chất hữu cơ A, dẫn sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH dư thấy khối lượng bình 1 tăng 0,54 g bình 2 tăng 0,88 g. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Đáp án hướng dẫn giải chi tiết
A + O2 CO2+ H2O
Bình 1 tăng là do H2O bị giữ lại.
→ mH2O = 0,54 gam
→ nH2O= 0,54/18 = 0,03 mol
Bình 2 là do CO2 phản ứng bị giữ lại
→ m CO2 = 0,88 gam
→ nCO2 = 0,88/44 = 0,02 mol
→ nC = nCO2 = 0,02 mol
nH= 2nH2O= 0,06 mol
→ mC= 0,02.12 = 0,24 gam
mH =0,06.1= 0,06 gam
→%mC= 0,24/0,46 .100 = 52,174%
%mH=0,06/0,46 .100 =13,04%
→%mO =100%− 52,174% − 13,04% = 34,786%
Bài 6. Nilon – 6, loại tơ nilon phổ biến nhất có 63,68% C; 9,08 % H; 14,14% O; và 12,38% N. Xác định công thức đơn giản nhất của nilon – 6.
Hướng dẫn giải bài tập
Ta có nC:nH:nN =
Công thức thực nghiệm của nilon là C6H11ON
Bài 7. Kết quả phân tích các nguyên tố trong nicotin như sau: 74% C; 8,65% H; 17,35% N. Xác định công thức đơn giản nhất của nicotin, biết nicotin có khối lượng mol phân tử là 162.
Đáp án hướng dẫn giải
Gọi CT nicotin là CxHyNz
x : y : z = %C/12: %H/1: %N/14 = 74/12 : 8,65/1 : 17,35/14= 5: 7 :1
=> CT (C5H7N)n . Mà M = (12.5 + 7 + 14)n = 162 => n = 2 => CT: C10H14N2
Bài 8. Đốt cháy hoàn toàn 5,6 g hợp chất hữu cơ A thu được 13,2 g CO2 và 3,6 g H2O. Tỉ khối của A so với H2 là 28. Xác định CTPT của A.
Đáp án hướng dẫn giải
Ta có nCO2 = nC = 0,3
nH = 2nH2O = 0,4
mO trong A = 5,6 - 0,3.12 - 0,4= 1,6 => nO = 0,1mol
=> CT (C3H4O)n . M = ( 12.3 + 4 + 16)n = 28.2=> n = 1 => CT A: C3H4O
Bài 9. Đốt cháy hoàn toàn 0,30 g chất A (chứa C, H, O) thu được 0,44 g CO2 và 0,18 g H2O. Thể tích hơi của của 0,30 g chất A bằng thể tích của 0,16g khí oxi (ở cùng đk về nhiệt độ và áp suất). Xác định CTPT của chất A.
Đáp án hướng dẫn giải
Gọi công thức hợp chất hữu cơ là CxHyOz (x,y,z nguyên dương)
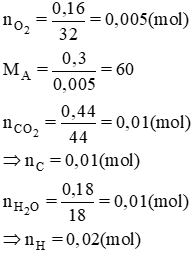
mO = mA – (mC + mH) = 0,3 - (0,01.12 + 0,02.1) = 0,16(g)
⇒ nO = = 0,01(mol)
nC : nH : nO = 0,01 : 0,02 : 0,01 = 1 : 2 : 1
⇒ công thức phân tử (CH2O)n
Ta có: mA = 30n = 60 ⇒ n = 2
⇒ Công thức phân tử của A là C2H4O2
Bài 10. Từ tinh dầu hồi, người ta tách được anetol – một chất thơm được dùng sản xuất kẹo cao su. Anetol có khối lượng mol phân tử bằng 148 g/mol. Phân tích nguyên tố cho thấy, anetol có %C = 81,08%; %H = 8,10% còn lại là oxi. Lập công thức đơn giản nhất và CTPT của anetol.
Đáp án hướng dẫn giải
%O = 100% - 81,08% - 8,1% = 10, 82%
x : y : z =
= 10: 12: 1
=> Công thức đơn giản nhất = C10H12O
=> (C10H12O)n = 148 => n = 1 => CTPT : C10H12O
Bài 11. Hợp chất X có phần trăm khối lượng C, H, O lần lượt bằng 54,54%; 9,10% và 36,36%. Khối lượng mol phân tử của X bằng 88. Xác định CTPT của X.
Đáp án hướng dẫn giải
Gọi công thức tổng quát của X là CxHyOz (x,y,z € N*)
=> Công thức đơn giản nhất của X là C2H4O
=> Công thức tổng quát là (C2H4O)n
Ta có: MX = 88 (g/mol)
(12.2 + 4+ 16)n = 88
=> n = 2
Vậy công thức phân tử là C4H8O2
Bài 12. Từ tinh dầu chanh người ta tách được chất limonen thuộc loại hiđrocacbon có hàm lượng nguyên tố H là 11,765%. Hãy tìm CTPT của limonen, biết tỉ khối hơi của limonen so với heli bằng 34.
Đáp án hướng dẫn giải
Gọi công thức của limonen là CxHy
Ta có:
%H = 100% - %H = 100% -11,765% = 88,235%
Dlimonen/kk = 4,69 →Mlimonen = 4,69.29 = 136
Ta có:
→ x : y = 5: 8
Vậy công thức đơn giản nhất của limonen là (C5H8)n
Vì Mlimonen = 136 →→ n(12.5 + 8.1) = 136 →→ n = 2
Vậy công thức phân tử của limonen là C10H16
Bài 13. Đốt cháy hoàn toàn hợp chất hữu cơ A cần vừa đủ 6,72 lít O2 (ở đktc) thu được 13,2 g CO2 và 5,4 g H2O. Biết tỉ khối hơi của A so với không khí gần bằng 1,0345. Xác định CTPT của A.
Đáp án hướng dẫn giải
nO2 = 6,72 : 22,4 = 0,3 mol
Bảo toàn khối lượng: mA + mO2 = mH2O + mCO2
→ mA = 13,2 + 5,4 - 0,3 . 32 = 9 (g)
nCO2 = 13,2 : 44 = 0,3 mol
nH2O = 5,4 : 18 = 0,3 mol
Gọi CTPT của A là CxHyOz
Trong A có:
nC = nCO2 = 0,3 mol
nH = 2nH2O = 0,6 mol
Bảo toàn nguyên tố O: nO = 2.nCO2 + nH2O - 2.nO2 = 0,3 mol
x:y:z = nC : nH : nO = 0,3 : 0,6 : 0,3 = 1:2:1
→ CTĐGN của A: CH2O
→ A có dạng (CH2O)n
MA = 29 . 1,0345 = 30
30n = 30 → n = 1
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
30 Bài tập về Nitrogen (2024) có đáp án chi tiết nhất
30 Bài tập về Cân bằng trong dung dịch nước (2024) có đáp án chi tiết nhất
30 Bài tập về Khái niệm về cân bằng hoá học (2024) có đáp án chi tiết nhất
30 bài tập về Sulfuric acid và muối sulfate (2024) có đáp án chi tiết nhất












