Bài tập về Cân bằng trong dung dịch nước
Lý thuyết
1. Sự điện ly
a. Hiện tượng điện ly
Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra các ion được gọi là chất điện li.
b. Chất điện ly
* Chất điện ly và chất không điện ly
Thí nghiệm trên cho thấy các chất như . ... n II. 17 II, Na*(aq) + OH(aq), HCl(aq) — Ví dụ: NaOH(aq) H*(aq) + C (aq) bì Chất đến lí mạnh và chất diễn là yếu
- Chất điện li là các chất tan trong nước phân là ra các ion. Ví dụ như hydrochloric acid, sodium hydroxide...
- Chất không điện li là các chất không phân li ra các ion. Ví dụ như Saccarose, ethanol,…
Sự phân li một chất thành các ion mang điện trái dấu trong dung dịch được biểu diễn bằng phương trình điện ly.
* Chất điện ly mạnh và chất điện ly yếu
Dựa vào mức độ phân li thành các ion, chất điện li được chia thành hai loại:
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân Ii ra ion. Các chất điện là mạnh thường gặp như: HCl, HNO3,..(acid mạnh); NaOH, KOH,…(base mạnh); và hầu hết các muối.
- Quá trình phân li của chất điện li mạnh xảy ra gần như hoàn toàn và được biểu diễn bằng mũi tên một chiều.
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch như CH3COOH, HClO,…(acid yếu) hay Cu(OH)2, Fe(OH)2,… (base yếu)
- Quá trình phần li của chất điện là yếu là một phản ứng thuận nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều nhau.
2. Thuyết ACID-BASE của BRONSTED — LOWRY
a. Khái niệm acid và base theo thuyết Bronsted – Lowry
Thuyết Bronsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
a. Ưu điểm của thuyết Bronsted – Lowry
Thuyết Bronsted – Lowry có nhiều ưu điểm hơn thuyết Arrhenius:
+ Thuyết Arrhenius chỉ đúng trong trường hợp dung môi là nước.
+ Thuyết Bronsted – Lowry có cái nhìn tổng quát hơn về axit và bazo, giúp ta giải thích được 1 số muối lại hoạt động như 1 bazo.
3. Khái niệm pH và ý nghĩa của pH trong cuộc sống
a. Khái niệm pH
pH là đại lượng thay thế cho những số có số mũ âm hoặc có nhiều chữ số thập phân khi dùng nồng độ ion H+ hoặc ion OH- được dùng để đánh giá tính acid hoặc tính base của các dung dịch mà H+ hoặc OH- thấp.
b. Ý nghĩa của pH trong thực tiễn
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ của con người, sự phát triển của động vật, thực vật.
Trong cơ thể của người, máu và các dịch của dạ dày, mật, .. đều có giá trị pH trong một khoảng nhất định. Chỉ số pH trong cơ thể có liên quan đến tình trạng sức khỏe. Nếu chỉ số pH tăng hoặc giảm đột ngột, không nằm trong giới hạn cho phép thì có thể là dấu hiệu ban đầu của bệnh lí, người bệnh cần được khám để tìm ra nguyên nhân.
Một số động vật sống dưới nước cần môi trường có giá trị pH thích hợp, ví dụ: tôm và cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5.
c. Xác định pH
Giá trị pH của dung dịch được xác định gần đúng bằng cách sử dụng chất chỉ thị acid – base. Khi cần xác định giá trị pH chính xác hơn, người ta sử dụng máy đo pH.
Chất chỉ thị acid – base là chất có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch. Một số chất chỉ thị như giấy pH, giấy qùy. phenolphthalein có màu sắc thay đổi trong các khoảng pH khác nhau.
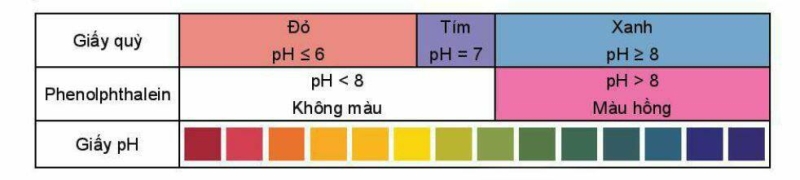
4. Sự thủy phân của các ion
Khi tan trong nước, muối phân li thành các ion. Phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau được gọi là phản ứng thuỷ phân.
5. Chuẩn độ Acid-base
Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ. Dựa vào thể tích của các dung dịch khi phản ứng vừa đủ với nhau, xác định được nồng độ dung dịch chất cần chuẩn độ.
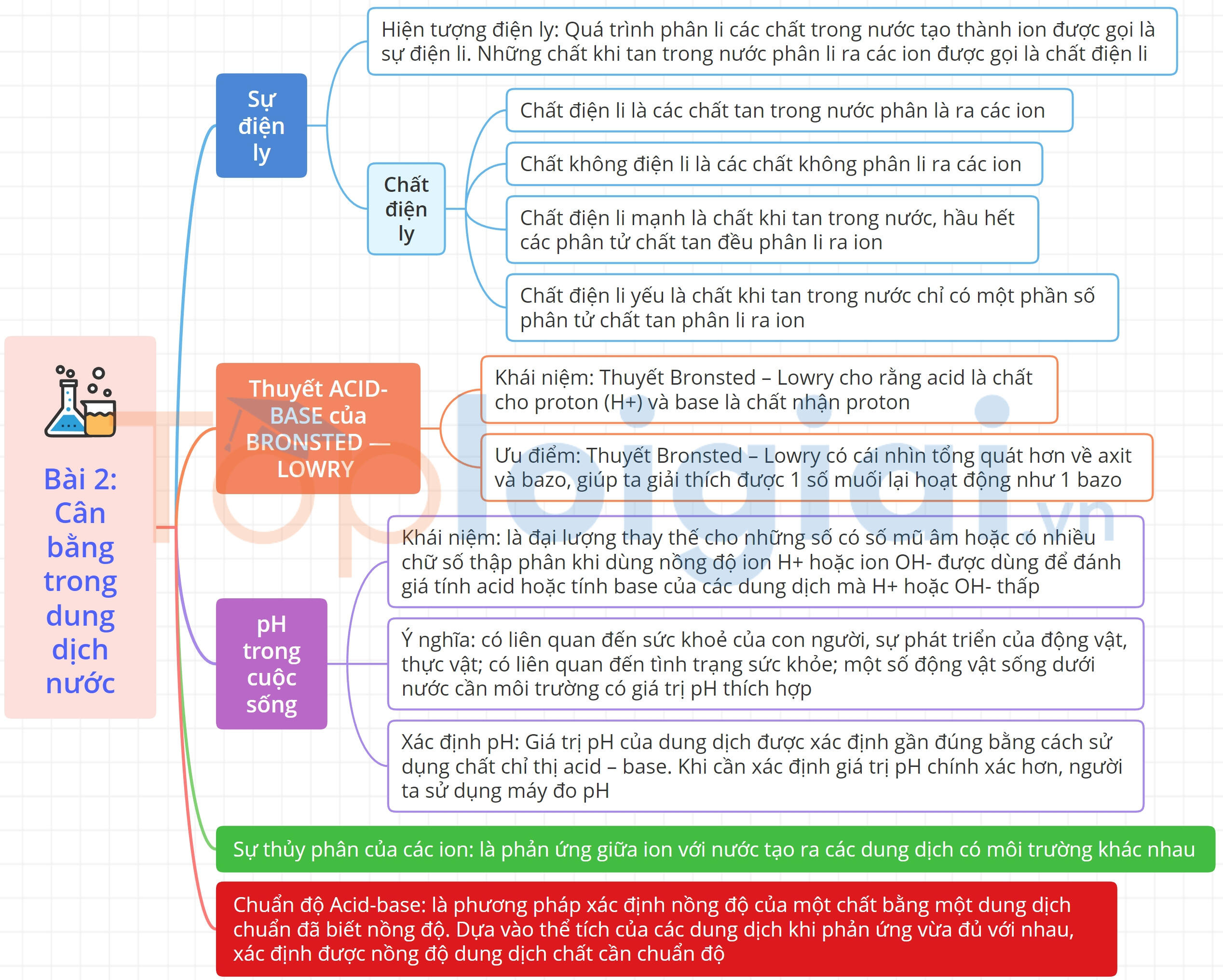
Sơ đồ tư duy Cân bằng trong dung dịch nước
Bài tập tự luyện
Bài 1: Phản ứng : 2SO2 + O2 ⇆ 2SO3 ΔH < 0. Khi giảm nhiệt độ và khi giảm áp suất thì cân bằng của phản ứng trên chuyển dịch tương ứng là :
A. Thuận và thuận. B. Thuận và nghịch.
C. Nghịch và nghịch. D. Nghịch và thuận.
Đáp án: B
Bài 2: Cho cân bằng (trong bình kín) sau:
CO (k) + H2O (k) ⇆ CO2 (k) + H2 (k); ΔH < 0
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác. Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là :
A. (1), (4), (5). B. (1), (2), (3).
C. (2), (3), (4). D. (1), (2), (4).
Đáp án: B
Bài 3: Trong phòng thí nghiệm người ta điều chế NO2 bằng cách cho Cu tác dụng với HNO3 đặc, đun nóng. NO2 có thể chuyển thành N2O4 theo cân bằng :
2NO2 ⇆ N2O4
Cho biết NO2 là khí có màu nâu và N2O4 là khí không màu. Khi ngâm bình chứa NO2 vào chậu nước đá thấy màu trong bình khí nhạt dần. Hỏi phản ứng thuận trong cân bằng trên là :
A. Toả nhiệt.
B. Thu nhiệt.
C. Không toả hay thu nhiệt.
D. Một phương án khác.
Đáp án: A
Bài 4: Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng:
N2 + 3H2 ⇆ 2NH3
Sau một thời gian, nồng độ các chất trong bình như sau: [N2] = 2M; [H2] = 3M; [NH3] = 2M. Nồng độ mol/l của N2 và H2 ban đầu lần lượt là :
A. 3 và 6. B. 2 và 3.
C. 4 và 8. D. 2 và 4.
Đáp án: A
Gọi nồng độ ban đầu của N2 và H2 là a và b
Ta có: [N2] pư = [H2]pư/3 = ([NH3]tạo thành)/2
a – 2 = (b-3)/3 = 2/2
⇒ a = 3; b = 6
Bài 5: Thực hiện phản ứng tổng hợp amoniac N2 + 3H2 ⇆ 2NH3.
Nồng độ mol ban đầu của các chất như sau: [N2] = 1 mol/l; [H2] = 1,2 mol/l. Khi phản ứng đạt cân bằng nồng độ mol của [NH3] = 0,2 mol/l. Hiệu suất của phản ứng là :
A. 43%. B. 10%.
C. 30%. D. 25%.
Đáp án: D
[N2] = 1 mol/l; [H2] = 1,2 mol/l ⇒ H2 hết; hiệu suất tính theo H2
[NH3] = 0,2 mol/l ⇒ [H2]pư = 0,3 mol/l
H = 0,3 : 1,2 . 100% = 25%
Bài 6: Cho cân bằng hóa học:
N2 (k) + 3H2 ⇌ 2NH3 (k)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi
A. thay đổi áp suất của hệ
B. thay đổi nồng độ N2
C. thay đổi nhiệt độ
D. thêm chất xúc tác Fe
Đáp án: D
Bài 7: Cho các cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
N2 (k) + 3H2 ⇌ 2NH3 (k)
3CO2 (k) + H2 (k) ⇌ CO (k) + H2O (k)
2HI (k) ⇌ H2 (k) + I2 (k)
Khi thay đổi áp suất, các cân bằng hóa học đều không bị chuyển dịch là
A. (1) và (3)
B. (2) và (4)
C. (1) và (2)
D. (3) và (4)
Đáp án: D
Bài 8: Trong một bình kín có cân bằng hóa học sau:
2NO2 (k) ⇌ N2O4 (k)
Tỉ khối hơi của hỗn hợp khí trong bình so với H2 ở nhiệt độ T1 bằng 27,6 và ở nhiệt độ T2 bằng 34,5. Biết T1 > T2.
Phát biểu nào sau đây về cân bằng trên là đúng?
A. Phản ứng thuận là phản ứng tỏa nhiệt.
B. Khi tăng nhiệt độ, áp suất chung của hệ cân bằng giảm.
C. Khi giảm nhiệt độ, áp suất chung của hệ cân bằng tăng.
D. Phản ứng nghịch là phản ứng tỏa nhiệt.
Đáp án: A
Bài 9: Xét cân bằng: N2(k) + 3H2(k) ⇆ 2NH3(k)
Biểu thức hằng số cân bằng của phản ứng là :
Đáp án: B
Bài 10: Cho các cân bằng:
(1) H2 (k) + I2 (k) ⇆ 2HI (k)
(2) 2NO (k) + O2 (k) ⇆ 2NO2 (k)
(3) CO (k) + Cl2(k) ⇆ COCl2 (k)
(4) CaCO3 (r) ⇆ CaO (r) + CO2 (k)
(5) 3Fe (r) + 4H2O (k) ⇆ Fe3O4 (r) + 4H2 (k)
Các cân bằng chuyển dịch theo chiều thuận khi tăng áp suất là :
A. (1), (4). B. (1), (5).
C. (2), (3), (5). D. (2), (3).
Đáp án: D
Bài 11: Cho cân bằng hóa học sau:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k) ; ΔH < 0
Cho các biện pháp:
Tăng nhiệt độ;
Tăng áp suất chung của hệ phản ứng;
Hạ nhiệt độ;
Dùng thêm chất xúc tác V2O5;
Giảm nồng độ SO3;
Giảm áp suất chung của hệ phản ứng.
Trong các biện pháp trên, những biện pháp nào làm cân bằng chuyển dịch theo chiều thuận?
A. (1), (2), (4), (5)
B. (2), (3), (5)
C. (2), (3), (4), (6)
D. (1), (2), (5)
Đáp án: B
Bài 12: Cho cân bằng hóa học:
H2 (k) + I2 (k) ⇌ 2HI (k); ΔH > 0
Cân bằng không bị chuyển dịch khi
A. tăng nhiệt độ của hệ
B. giảm nống độ HI
C. tăng nồng độ H2
D. giảm áp suất chung của hệ.
Đáp án: D
Bài 13: Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu nào sau đây đúng khi nói về cân bằng hóa học này?
A. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch tỏa nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ.
Đáp án: D
Bài 14: Cho cân bằng hóa học sau trong bình kín:
2NO2 (k) ⇌ N2O4 (k)
(màu nâu đỏ) (không màu)
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. ΔH > 0, phản ứng tỏa nhiệt
B. ΔH < 0, phản ứng tỏa nhiệt
C. ΔH > 0, phản ứng thu nhiệt
D. ΔH <0, phản ứng thu nhiệt
Đáp án: B
Bài 15: Cho cân bằng hóa học:
2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu nào sua đây đúng?
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3
Đáp án: B
Đề 2
Câu 1: Phương trình điện li viết đúng là
A.
B.
C. KOH → K+ + OH−.
D.
Đáp án đúng là: C
Ethanol không điện li.
Câu 2: Phương trình điện li nào sau đây không đúng?
A.
B. BaCl2 → Ba2+ + 2Cl-
C. HF H+ + F−
D. K2SO4 2K+ + SO42-
Đáp án đúng là: D
Câu 3: Cho phương trình:NH3 + H2O NH4+ + OH-
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là base?
A. NH3.
B. H2O.
C. NH4+.
D. OH-.
Đáp án đúng là: A
Vì trong phản ứng trên theo chiều thuận, NH3 là chất nhận nên NH3 là base.
Câu 4: Cho phương trình:CH3COOH + H2O CH3COO- + H3O+
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là acid?
A. CH3COOH.
B. H2O.
C. CH3COO-.
D. H3O+.
Đáp án đúng là: A
Vì trong phản ứng trên theo chiều thuận, CH3COOH là chất cho nên CH3COOH là acid.
Câu 5: Theo thuyết Bronsted – Lowry, dãy các chất nào sau đây là base?
A. Fe2+, HCl, PO43-.
B. CO32-, SO32-, PO43-.
C. Na+, H+, Al3+.
D. Fe3+, Ag+, H2CO3.
Đáp án đúng là: B
Các ion CO32-, SO32-, PO43- đều nhận từ nước nên đều là base.
Câu 6: Dung dịch nào sau đây có khả năng dẫn điện?
A. Dung dịch saccharose.
B. Nước muối.
C. Dung dịch ethanol.
D. Nước tinh khiết.
Đáp án đúng là: B
Trong nước muối, phân tử NaCl phân li trong nước tạo các ion nên dung dịch này dẫn điện.
Câu 7: Chất nào sau đây là chất điện li?
A. Cl2.
B. HNO3.
C. MgO.
D. CH4.
Đáp án đúng là: B
Trong nước, HNO3 phân li: nên HNO3 là chất điện li.
Câu 8: Chất nào sau đây không phải chất điện li?
A. KOH.
B. H2S.
C. HNO3.
D. C2H5OH.
Đáp án đúng là: D
Vì các chất điện li là KOH, H2S, HNO3
Câu 9: Chất nào sau đây thuộc loại chất điện li mạnh?
A. CO2.
B. NaOH.
C. H2O.
D. H2S.
Đáp án đúng là: B
Vì NaOH là một base mạnh, các phân tử đều phân li ra ion:
Câu 10: Chất nào sau đây thuộc loại chất điện li yếu?
A. KCl.
B. HF.
C. HNO3.
D. NH4Cl.
Đáp án đúng là: B
HF là một acid yếu:
Câu 11: Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thủy phân, còn cation kim loại trung bình và yếu bị thủy phân tạo môi trường acid, gốc acid yếu bị thủy phân tạo môi trường base. Dung dịch muối nào sau đây có pH > 7?
A. KNO3
B. K2SO4
C. Na2CO3
D. NaCl
Đáp án đúng là: C
Vì trong dung dịch Na2CO3 có gốc acid CO32-yếu:
Câu 12: pH của dung dịch nào sau đây có giá trị nhỏ nhất?
A. Dung dịch HCl 0,1M
B. Dung dịch CH3COOH 0,1M
C. Dung dịch NaCl 0,1M
D. Dung dịch NaOH 0,01M
Đáp án đúng là: A
Vì NaOH là một base mạnh nên pH > 7, xét về nồng độ bằng nhau của các dung dịch còn lại thì HCl là một acid mạnh sẽ có giá trị pH nhỏ nhất.
Câu 13: Trong các dung dịch acid sau có cùng nồng độ 0,1 M, dung dịch nào có pH cao nhất?
A. HF.
B. HCl.
C. HBr.
D. HI.
Đáp án đúng là: A
HCl, HBr, HI là các acid mạnh, HF là acid yếu nên sẽ có pH cao nhất.
Câu 14: Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Đáp án đúng là: C
Cốc nước chanh được giá trị pH bằng 2,4 nên nồng độ ion [H+] của nước chanh là 10-2,4 = 0,004 mol/L.
Câu 15: Giá trị pH của dung dịch HCl 0,001M là
A. 3.
B. 11.
C. 12.
D. 2.
Đáp án đúng là: A
Nồng độ ion [H+] của dung dịch HCl 0,001M là 10-3 = 0,001 mol/L nên giá trị pH của dung dịch HCl 0,001 là 3.
Xem thêm các dạng bài tập và câu hỏi liên quan khác:
70 Bài tập về phenol (2024) có đáp án chi tiết nhất
70 Bài tập về ancol (2024) có đáp án chi tiết nhất
30 Bài tập về hệ thống hóa về hiđrocacbon (2024) có đáp án chi tiết nhất
30 Bài tập về nguồn hiđrocacbon thiên nhiên (2024) có đáp án chi tiết nhất




