Bài tập về Sulfuric acid và muối sulfate
1. Lý thuyết và phương pháp giải
1.1 Sulfuric acid
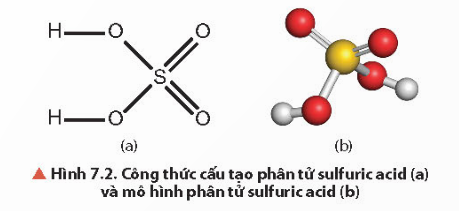
a) Tính chất vật lý và cấu tạo phân tử:
- Là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84g/cm3).
- Trong phân tử của H2SO4, các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. 2 liên kết đơn O – H, 2 liên kết đơn O – S và 2 liên kết đôi S = O.
b) Tính chất hóa học và ứng dụng
- Dung dịch H2SO4 loãng có tính chất chung của acid như:
+ Làm quỳ tím hóa đỏ
+ Tác dụng với kim loại
+ Tác dụng với basic oxide và base
+ Tác dụng với muối
-Dung dịch H2SO4 đặc, nóng có tính oxi hóa mạnh và tính háo nước
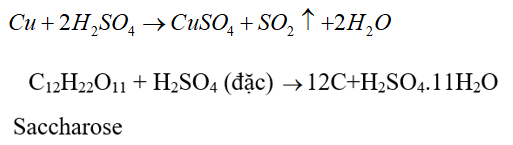
- Ứng dụng
+ Sulfuric acid đặc hấp thụ mạnh hơi nước nên được dùng để làm khô những khí không tác dụng với nó.
+ Dùng để sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo…
c) Cách bảo quản, sử dụng và nguyên tắc xử lí khi bỏng acid
- Khi sử dụng, bảo quản dung dịch sulfuric acid cần phải cẩn thận, tuân thủ đúng nguyên tắc an toàn.
- Cách pha loãng dung dịch H2SO4 đặc: đổ từ từ dung dịch H2SO4 đặc vào nước, tuyệt đối không làm ngược lại.
- Khi bị bỏng acid cần nhanh chóng bỏ quần áo bị dính acid, rửa ngay bằng nước sạch khoảng 20 phút sau đó đến cơ sở ý tế gần nhất.
d) Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc
- Giai đoạn 1: Sản xuất SO2:
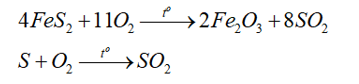
- Giai đoạn 2: Sản xuất SO3
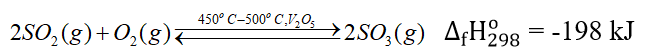
- Giai đoạn 3: Sản xuất H2SO4
1.2 Muối Sulfate
a) Ứng dụng của một số muối sulfate
- CaSO4 được dùng sản xuất vật liệu xây dựng; làm chất phụ gia để làm đông các sản phẩm như đậu hũ, đậu non,…
- BaSO4 được sử dụng làm phụ gia pha màu cho công nghiệp sơn, cho thủy tinh, cho gốm sứ cách điện và cao su chất lượng cao.
-MgSO4 được sử dụng làm muối tắm, làm dịu cơ bắp khi sưng tấy; bổ sung cho tôm, cá,…
-(NH4)2SO4: thành phần của thuốc trừ sau hòa tan, thuốc diệt nấm, phân bón,…
b) Nhận biết sulfate ion
- Thuốc thử để nhận biết ion sulfate là ion Ba2+.
2. Ví dụ minh họa
Ví dụ 1: Cho hỗn hợp X gồm 3 kim loại: Fe; Zn và Cu.
+ TN1: Cho 4,74 gam X phản ứng hoàn toàn trong H2SO4 loãng thấy thoát ra 1,568 lít khí ở đktc.
+ TN2: Cho 0,16 mol X phản ứng với H2SO4 đặc, nóng, dư thấy thoát ra 4,704 lít khí SO2 là sản phẩm khử duy nhất ở đktc.
% khối lượng của Fe, Cu, Zn trong hỗn hợp ban đầu lần lượt là
A. 59,07%, 27,43% và 13,50%.
B. 59,07%, 13,50% và 27,43%.
C. 20 %, 20% và 60%.
D. 30%, 30% và 40%.
Lời giải:
Đáp án B
Gọi số mol Fe; Zn; Cu trong TN1 lần lượt là a,b,c (mol);
Theo Kl: 56a + 65b + 64c = 4,74 (1)
Bảo toàn e hoặc viết PTHH → a + b = 0,07 (2)
Gọi số mol Fe; Zn; Cu trong TN2 lần lượt là ka; kb; kc (mol)
⇒ k(a + b + c) = 0,16 (3)
lại có nSO2 = 0,21. Bảo toàn e hoặc viết PTHH → k(3a + 2b + 2c) = 0,42 (4)
Lấy (3)/(4)
⇒ 0,06a – 0,1b – 0,1c = 0 (5)
Từ (1), (2), (5) Giải hệ ⇒ a = 0,05; b = 0,02; c = 0,01
- %mFe = .100=59,07%
- %mZn = .100=27,43%
- %mCu = 100 – 59,07 – 27,43 = 13,5%
Ví dụ 2: Cho m(g) hỗn hợp A gồm 3 kim loại Al, Zn, Cu. Lấy 0,1 mol A tác dụng hết với dung dịch H2SO4 loãng, dư thu được 1,68 lít khí ở đktc và 2,4g kim loại không tan. Mặt khác, lấy 22,05g A Cho tác dụng với H2SO4 đặc, nóng, dư thu được a mol khí SO2 (đktc).Giá trị của a là
A. 0,45.
B. 0,35.
C. 0,55.
D. 0,25.
Lời giải:
Đáp án A
Trong 0,1 mol A:
- nCu = 0,0375 (mol)
- Gọi số mol Al; Zn x và y (mol);
⇒ x = 0,025; y = 0,0375 (mol)
- mA = 11,025 (mol)
Tính a:
Áp dụng định luật bảo toàn e: 2a = 2.(2.0,0375 + 3.0,025 + 2.0,0375) ⇒ a = 0,45 (mol).
Ví dụ 3: Hoà tan hoàn toàn 0,8125g một kim loại hoá trị II và dung dịch H2SO4 đặc, nóng thu được 0,28 lít khí SO2 (đktc). Kim loại đã dùng là
A. Mg.
B. Cu.
C. Zn.
D. Fe.
Lời giải:
Đáp án C
Bảo toàn số mol e có: 2.nKL = 2.nkhí
3. Bài tập vận dụng
Câu 1: Dung dịch H2SO4 loãng có thể tác dụng với cả 2 chất nào sau đây?
A. Cu và Cu(OH)2.
B. Fe và Fe(OH)3.
C. C và CO2.
D. S và H2S.
Lời giải:
Đáp án B
Fe + H2SO4 (l) → FeSO4 + H2
2Fe(OH)3 + 3H2SO4 (l) → Fe2(SO4)3 + 6H2O
Câu 2: H2SO4 đặc khi tiếp xúc với đường, vải, giấy có thể làm chúng hóa đen do tính chất nào dưới đây?
A. Oxi hóa mạnh.
B. Háo nước.
C. Axit mạnh.
D. Khử mạnh.
Lời giải:
Đáp án B
Câu 3: Cho 1,3g Zn và 0,56g Fe tác dụng với dung dịch H2SO4 loãng, dư thu được V lít khí (đktc). Giá trị của V là
A. 0,448l.
B. 0,224l.
C. 6,72l.
D. 0,672l.
Lời giải:
Đáp án D
nZn = 0,02 mol, nFe = 0,01 mol
khí sinh ra là H2
Bảo toàn số mol e ta có: 2nZn + 2nFe = 2nkhí → nkhí = 0,03 mol
→ V = 0,03.22,4 = 0,672 lít.
Câu 4: Cho 0,96g Cu phản ứng hoàn toàn với dung dịch H2SO4 đặc, nóng, dư thu được V lít khí SO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 0,448 lít.
B. 0,336 lít.
C. 0,112 lít.
D. 0,224 lít.
Lời giải:
Đáp án B
nCu = 0,015 mol
bảo toàn số mol e: 2.nCu = 2.nkhí → nkhí = 0,015 mol
→ V = 0,015.22,4 = 0,336 lít.
Câu 5: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là?
A. 9,52.
B. 10,27.
C. 8,98.
D. 7,25.
Lời giải:
Đáp án C
Bảo toàn nguyên tố H có naxit = nkhí = 0,06 mol
Bảo toàn khối lượng: mx + maxit = mmuối + mkhí
→ mmuối = 3,22 + 0,06.98 – 0,06.2 = 8,98 gam.
Câu 6: Hoà tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là
A. 80.
B. 40.
C. 20.
D. 60.
Lời giải:
Đáp án B
Fe (0,1) + H2SO4 → FeSO4 (0,1 mol) + H2
10FeSO4 (0,1) + 2KMnO4 (0,02 mol) + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
V = 0,02 : 0,5 = 0,04 lít = 40ml.
Câu 7: Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,24 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
A. 101,68 gam.
B. 88,20 gam.
C. 101,48 gam.
D. 97,80 gam.
Lời giải:
Đáp án C
Bảo toàn H có naxit = nkhí = 0,1 mol → mdd axit = 0,1.98 : 10% = 98 gam.
Bảo toàn khối lượng: mkl + mdd axit = mdd muối + mkhí
→ mdd muối = 3,68 + 98 – 0,1.2 = 101,48 gam.
Câu 8: Cho 0,01 mol một hợp chất của sắt tác dụng hết với H2SO4 đặc nóng (dư), thoát ra 0,112 lít (ở đktc) khí SO2 (là khí duy nhất và là sản phẩm khử duy nhất). Công thức của hợp chất sắt đó là
A. FeS.
B. FeS2.
C. FeO.
D. FeCO3.
Lời giải:
Đáp án C
nkhí = 0,005 mol
Khí thu được chỉ có SO2 → loại FeCO3
Bảo toàn e có: n.0,01 = 2.0,005 → n = 1 (n là số e nhường)
→ FeO thỏa mãn.
Câu 9: Dung dịch H2SO4 loãng phản ứng được với tất cả các chất trong dãy nào sau đây?
A. Al2O3, Ba(OH)2, Ag.
B. CuO, NaCl, CuS.
C. FeCl3, MgO, Cu.
D. BaCl2, Na2CO3, FeS.
Lời giải:
Đáp án D
Ag, Cu, CuS không phản ứng với H2SO4 loãng.
Câu 10: Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
A. Na.
B. Al.
C. Mg.
D. Cu.
Lời giải:
Đáp án D
Cu đứng sau H trong dãy hoạt động hóa học của kim loại.
Câu 11: Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng, thu được V lít H2 (đktc). Giá trị của V là
A. 2,24.
B. 3,36.
C. 1,12.
D. 4,48.
Lời giải:
Đáp án A
Câu 12: Cho 20 gam hỗn hợp Cu và Al phản ứng với dung dịch H2SO4 loãng, dư thấy thu được 13,44 lít khí (đktc). % theo khối lượng Al và Cu trong hỗn hợp lần lượt là
A. 44% và 66%.
B. 54% và 46%.
C. 50% và 50%.
D. 94% và 16%.
Lời giải:
Đáp án B
Cu không phản ứng
Bảo toàn e → 3.nAl = 2.nkhí → nAl = 0,4
%mAl = 54%.
Câu 13: Công thức của oleum là
A. H2SO4.SO3.
B. H2SO4.nH2O.
C. H2SO4.nSO3.
D. H2SO4.nSO2.
Lời giải:
Đáp án C
Câu 14: Cách pha loãng H2SO4 đặc an toàn là?
A. Rót nước vào axit, khuấy đều.
B. Rót từ từ nước vào axit, khuấy đều.
C. Rót từ từ axit vào nước, khuấy đều.
D. Rót nhanh axit vào nước, khuấy đều.
Lời giải:
Đáp án C
Câu 15: Phản ứng nào sau đây là sai?
A. 2FeO + 4H2SO4đặc→ Fe2(SO4)3+ SO2 + 4H2O.
B. Fe2O3+ 4H2SO4đặc→ Fe2(SO4)3 + SO2 + 4H2O.
C. FeO + H2SO4loãng→ FeSO4+ H2O .
D.Fe2O3+ 3H2SO4loãng→ Fe2(SO4)3 + 3H2O.
Lời giải:
Đáp án B
Fe2O3 + 3H2SO4đặc → Fe2(SO4)3 + 3H2O.
Câu 16: Axit sunfuric đặc thường được dùng để làm khô các chất khí ẩm. Khí nào sau đây có thể được làm khô nhờ axit sunfuric đặc?
A. Khí CO2.
B. Khí H2S.
C. Khí NH3.
D. Khí SO3.
Lời giải:
Đáp án A
CO2 không phản ứng với axit sunfuric đặc.
Câu 17: Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 đặc, nóng, dư thấy thu được V lít SO2 (đktc) là sản phẩm khử duy nhất. Giá trị của V là
A. 2,24.
B. 3,36.
C. 1,12.
D. 4,48.
Lời giải:
Đáp án A
Bảo toàn số mol electron có:
2.nZn = 2.nkhí → nkhí = nZn = 0,1 mol
V = 0,1.22,4 = 2,24 lít.
Câu 18: Hòa tan hết 0,2 mol Fe(OH)2 bằng dung dịch H2SO4 đặc, nóng (dư), thu được V lít (đktc) khí SO2 (sản phẩm khử duy nhất). Giá trị của V là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
Lời giải:
Đáp án A
Bảo toàn số mol electron có:
V = 0,1.22,4 = 2,24 lít.
Câu 19: Cho FeCO3 tác dụng với H2SO4 đặc, nóng, sản phẩm khí thu được là
A. CO2và SO2.
B. SO3và CO2.
C. SO2.
D. CO2.
Lời giải:
Đáp án A
2FeCO3 + 4H2SO4đặc → Fe2(SO4)3 + 2CO2 + SO2 + 4H2O
Câu 20: Để nhận ra sự có mặt của ion sunfat trong dung dịch, người ta thường dùng
A. quỳ tím.
B. dung dịch muối Mg2+.
C. dung dịch chứa ion Ba2+.
D. thuốc thử duy nhất là Ba(OH)2.
Lời giải:
Đáp án C
Ba2+ + SO42- → BaSO4 (↓ trắng).
Câu 21: Các khí sinh ra khi cho saccarozơ vào dung dịch H2SO4 đặc, dư là
A. H2S và CO2.
B. H2S và SO2.
C. SO3và CO2.
D. SO2và CO2.
Lời giải:
Đáp án D
Câu 22: Những kim loại nào sau đây bị thụ động hóa trong dd H2SO4 đặc, nguội?
A. Al và Zn.
B. Al và Fe.
C. Fe và Cu.
D. Fe và Mg.
Lời giải:
Đáp án B
Câu 23: Cho các chất: Cu, CuO, NaCl, Mg, KOH, C, Na2CO3 số chất vừa tác dụng với dung dịch H2SO4 loãng, vừa tác dụng với dung dịch H2SO4 đặc, nóng là
A. 3.
B. 4.
C. 5.
D. 6.
Lời giải:
Đáp án B
4 chất là CuO, Mg, KOH, Na2CO3.
Câu 24: Cho 11,2 gam Fe và 6,4 gam Cu tác dụng với dung dịch H2SO4 loãng, dư. Sau phản ứng thu được V lít khí H2 (đktc). Giá trị của V là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
Lời giải:
Đáp án C
Cu không phản ứng
→ V = 0,2.22,4 = 4.48 lít.
Câu 25: Khi cho Fe vào các axit sau, trường hợp nào không xảy ra phản ứng?
A. HCl.
B. H2SO4đặc, nóng.
C. H2SO4loãng.
D. H2SO4đặc, nguội.
Lời giải:
Đáp án D
Fe bị thụ động trong H2SO4đặc, nguội.
Xem thêm các dạng câu hỏi và bài tập liên quan khác:
30 bài tập về Ammonia. Muối ammonium (2024) có đáp án chi tiết nhất
30 Bài tập về Nitrogen (2024) có đáp án chi tiết nhất
30 Bài tập về Tính chất của nitơ, photpho và các hợp chất của chúng (2024) có đáp án chi tiết nhất
500 Bài tập Hóa 11 Chương 2: Nitơ - Photpho (có đáp án năm 2023)
30 Bài tập về Axit nitric và muối nitrat (2024) có đáp án chi tiết nhất




