Bài tập Cấu tạo nguyên tử
Kiến thức cần nhớ
1. Thành phần của nguyên tử
a) Các hạt cấu tạo nên nguyên tử
Thành phần cấu tạo của nguyên tử gồm:
- Hạt nhân: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ trường hợp H11).
- Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
Khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử:
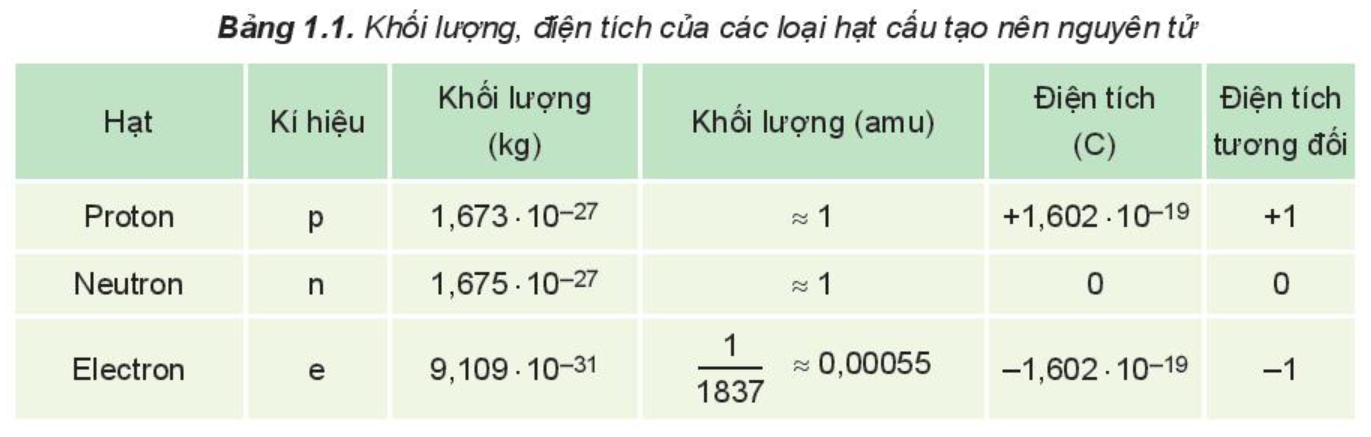
Chú ý: Trong nguyên tử, số proton bằng số electron. Nguyên tử trung hòa về điện.
b) Kích thước và khối lượng nguyên tử
Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử
Khối lượng nguyên tử tập trung ở hạt nhân (do khối lượng của electron rất nhỏ so với khối lượng của proton và neutron).
2. Nguyên tố hóa học
a) Số khối
Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
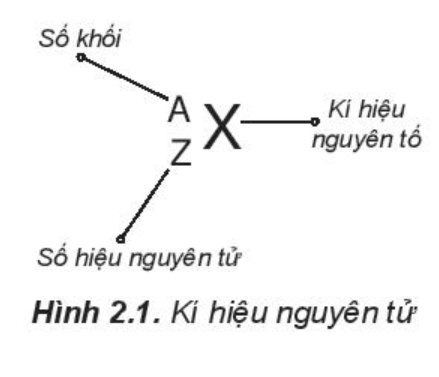
b) Kí hiệu nguyên tử
Khi viết kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở phía dưới và số khối A ở phía trên.
c) Đồng vị
∗ Khái niệm
Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
∗ Nguyên tử khối trung bình
Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu ˉA) của hỗn hợp các đồng vị của nguyên tố đó.
Biểu thức tổng quát tính nguyên tử khối trung bình (ˉA):
ˉA=(X.a)+(Y.b)+...100
Trong đó, ˉA là nguyên tử khối trung bình; X và Y, … lần lượt là nguyên tử khối của các đồng vị X và Y, …; a và b, … lần lượt là % số nguyên tử của các đồng vị X và Y, …
3. Cấu trúc lớp vỏ electron nguyên tử
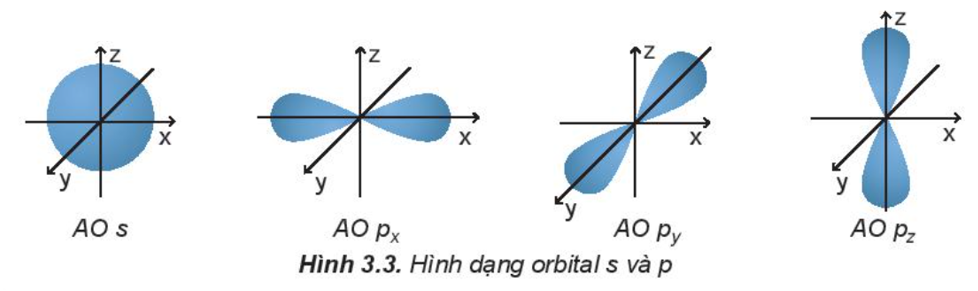
a) Hình dạng orbital nguyên tử
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
b) Lớp và phân lớp electron
|
n |
1 |
2 |
3 |
4 |
|
Lớp electron |
K |
L |
M |
N |
|
Phân lớp |
1s |
2s, 2p |
3s, 3p, 3d |
4s, 4p, 4d, 4f |
|
Số AO (n2) |
1 |
4 |
9 |
16 |
|
Số electron tối đa (2n2) |
2 |
8 |
18 |
32 |
Chú ý:
Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Trong lớp electron thứ n có n2 AO (n ≤ 4).
4. Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
Quy tắc Hund (Hun): Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
a) Viết cấu hình electron của nguyên tử
Bước 1: Xác định số electron trong nguyên tử.
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng: 1s 2s 2p 3s 3p 4s …
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng.
b) Đặc điểm của lớp electron ngoài cùng
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
|
Đặc điểm của lớp electron ngoài cùng |
||||
|
Số electron |
1, 2, 3 |
4 |
5, 6, 7 |
8 |
|
Loại nguyên tố |
Kim loại |
Kim loại hoặc phi kim |
Phi kim |
Khí hiếm (trừ He) |
Các dạng bài tập
DẠNG 1: TÌM SỐ P, E, N, SỐ KHỐI A - VIẾT KÍ HIỆU NGUYÊN TỬ
LƯU Ý: Ngtử X có số hạt ( p, n,e ) nhận thêm a electron → Ion Xa- có số hạt là ( p, n, e + Ngtử Y có số hạt (p, n, e) nhường (cho) b electron → Ion Yb+ có số hạt là ( p, n, e - b)
DẠNG 2: XÁC ĐỊNH NGTỬ KHỐI TRUNG BÌNH, SỐ KHỐI, % CÁC ĐỒNG VỊ
Dạng 1: Tính nguyên tử khối trung bình.
Nếu chưa có số khối A1; A2. ta tìm A1 = p + n1; A2 = p+ n2; A3 = p + n3
Áp dụng công thức :
A= trong đó A1, A2, A3 là số khối của các đồng vị 1, 2, 3
x1, x2, x3 là % số nguyên tử của các đồng vị 1, 2, 3 hoặc A =
trong đó A1, A2, A3 là số khối của các đồng vị 1, 2, 3
x1, x2, x3 là số nguyên tử của các đồng vị 1, 2, 3
Dạng 2: Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
=> % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình => giải được x.
Dạng 3: Xác định số khối của các đồng vị
Gọi số khối các đồng vị 1, 2 lần lượt là A1; A2.
Lập hệ 2 phương trình chứa ẩn A1; A2 => giải hệ được A1; A2.
DẠNG 3: TÌM NGTỐ VÀ VIẾT CẤU HÌNH E CỦA NGTỬ - ĐẶC ĐIỂM E CỦA LỚP, PHÂN LỚP
Tìm Z ⇒ Tên nguyên tố, viết cấu hình electron
DẠNG 4: VIẾT CẤU HÌNH E CỦA ION – XÁC ĐỊNH TÍNH CHẤT CỦA NGUYÊN TỐ
Từ cấu hình e của nguyên tử ⇒ Cấu hình e của ion tương ứng.
- Cấu hình e của ion dương : bớt đi số e ở phân lớp ngoài cùng của ngtử bằng đúng điện tích ion đó.
- Cấu hình e của ion âm : nhận thêm số e bằng đúng điện tích ion đó vào phân lớp ngoài cùng của nguyên tử.
Bài tập tự luyện
Bài 1: Tổng số hạt proton, electron và notron trong nguyên tử nguyên tố X là 10. Xác định tên nguyên tố X
Hướng dẫn giải:
Theo giả thiết ta có tổng số hạt cơ bản trong nguyên tử X là 10 nên :
p + n + e = 10 => 2p + n =10 (1)
Mặt khác ta lại có:
1≤np≤1,5 (2)
Từ (1) và (2) => 1≤10−2pp≤1,5⇒2,85≤p≤3,33⇒p=3
Vậy nguyên tố X là Liti (Li)
Bài 2: Nguyên tử của nguyên tố X có tổng các hạt cơ bản là 180 hạt, trong đó các hạt mang điện nhiều hơn các hạt không mang điện là 32 hạt. Tính số p và số n có trong X.
Hướng dẫn giải:
- Tổng số hạt cơ bản trong X là 180 hạt. Mà trong nguyên tử luôn có số p = số e
=> p + n + e = 180 => 2p + n = 180 (1)
- Trong X hạt mang điện nhiều hơn hạt không mang điện là 32 hạt
=> p + e – n = 32 => 2p – n = 32 (2)
Từ (1) và (2) => p = 53, n = 74
Bài 3: Tổng số hạt proton, nơtron, electron trong nguyên tử X là 28, trong đó số hạt không mang điện chiếm xấp xỉ 35% tổng số hạt. Số hạt mỗi loại trong nguyên tử X là bao nhiêu ?
Hướng dẫn giải:
- Tổng số hạt proton, nơtron, electron trong nguyên tử X là 28
=> p + n + e = 28 => 2p + e = 28 (1)
- Số hạt không mang điện chiếm xấp xỉ 35% tổng số hạt
=> n = 35% * (p + n + e) (2)
Thay (1) vào (2) => n = 35% * 28 = 10 (hạt)
=> p = e = (28 – 10) : 2 = 9
Vậy trong nguyên tử X, số p = số e = 9; số n = 10.
Bài 4: Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại A và B là 142, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 42. Số hạt mang điện của nguyên tử B nhiều hơn của nguyên tử A là 12. Xác định 2 kim loại A và B.
Hướng dẫn giải:
Gọi tổng số hạt proton, nơtron và electron của nguyên tử A là : pA, nA, eA và B là pB, nB, eB.
Ta có pA = eA và pB = eB.
Theo bài : Tổng số các loại hạt proton, nơtron và electron của hai nguyên tử A và B là 142 nên :
pA + nA + eA + pB + nB + eB = 142
2pA + 2pB + nA + nB = 142 (1)
Tổng số hạt mang điện nhiều hơn số hạt không mang điện là 42 nên :
pA + eA + pB + eB - nA - nB = 42 2pA + 2pB - nA- nB = 42 (2)
Số hạt mang điện của nguyên tử B nhiều hơn của nguyên tử A là 12 nên :
pB + eB - pA - eA = 12 2pB - 2pA = 12 pB - pA = 6 (3)
Từ (1), (2), (3) ta có : pA = 20 (Ca) và pB = 26 (Fe).
Bài 5: Nguyên tử kẽm (Zn) có nguyên tử khối bằng 65u. Thực tế hầu như toàn bộ khối lượng nguyên tử tập trung ở hạt nhân, với bán kính r = 2.10-15m. Khối lượng riêng của hạt nhân nguyên tử kẽm là bao nhiêu tấn trên một centimet khối (tấn/cm3)?
Hướng dẫn giải
r = 2.10-15m = 2.10-13cm.
V = 43πr3= 43(3,14.(2.10−13)3= 33,49.10-39cm3.
Ta có 1u = 1,66.10-27 kg = 1,66.10-30 tấn.
Khối lượng riêng hạt nhân = 65.1,66.10−3033,49.10−39= 3,32.109 tấn/cm3 .
Bài 6: Nguyên tử Al có bán kính 1,43và có nguyên tử khối là 27u. Khối lượng riêng của Al bằng bao nhiêu, biết rằng trong tinh thể nhôm các nguyên tử chỉ chiếm 74% thể tích, còn lại là các khe trống?
Hướng dẫn giải
rnguyeˆant¨oˆuAl=1,43.10−8cm
Vnguyên tử Al = 43.3,14.(1,43.10−8)3= 12,243.10-24 cm3
M nguyên tử Al =27.1,66.10−24gam
d nguyên tử Al =MV=27.1,66.10−2412,243.10−24=3,66g/cm3
Thực tế Vnguyên tử chiếm 74% thể tích tinh thể. Vậy d thực tế của Al là :
d = 3,66.74100 = 2,7g/cm3.
Bài 7: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể canxi các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Xác định bán kính nguyên tử canxi. Cho nguyên tử khối của Ca là 40.
Hướng dẫn giải
Trong tinh thể canxi các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể
=> Thể tích của 1 mol nguyên tử Ca chiếm 74% thể tích của 1 mol tinh thể nguyên tử canxi.
V 1 mol nguyên tử Ca = Md.74.
V 1 nguyên tử Ca =V1molCa6,023.1023= =401,55.6,023.1023.74.
Mặt khác : V1 nguyên tử Ca = 4πr33⇒r=3√3.401,55.6,023.1023.744π= 1,96.10-8 cm.
Xem thêm các dạng bài tập Hoá học 10 hay, chi tiết, đầy đủ khác:
30 Bài tập về Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học (2024) có đáp án chi tiết nhất
50 Bài tập thành phần của nguyên tử (2024) có đáp án chi tiết nhất
30 bài tập về Phản ứng oxi hóa - khử (2024) có đáp án chi tiết nhất
30 Bài tập về Mô hình nguyên tử và orbital nguyên tử (2024) có đáp án chi tiết nhất




