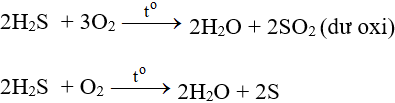Phản ứng SO2 + H2S → S + H2O
1. Phương trình phản ứng H2S ra S
SO2 + 2H2S → 3S↓ + 2H2O
SO2 là chất oxi hóa (bị khử) và H2S là chất khử (bị oxi hóa)
2. Điều kiện phản ứng SO2 ra S
Nhiệt độ thường
3. Hiện tượng phản ứng giữa SO2 tác dụng với H2S
Xuất hiện kết tủa vàng Lưu huỳnh (S).
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của SO2 (Lưu huỳnh dioxit)
- Trong phản ứng trên SO2 là chất oxi hoá.
- SO2 là chất oxi hoá mạnh nên tác dụng được với chất khử mạnh.
4.2. Bản chất của H2S (Hidro sunfua)
Trong phản ứng trên H2S là chất khử mạnh.
5. Tính chất hóa học của SO2
SO2 là một oxit axit, nên mang đầy đủ tính chất hóa học của một oxit axit.
5.1. Oxy hóa chậm trong không khí
SO2 + O2 SO3
SO2 dễ bị oxy hóa thành SO3 trong khí quyển dưới chất xúc tác hoặc do quá trình quang hóa.
Là một axit yếu, tác dụng với nước tạo ra H2SO3
SO2 + H2O → H2SO3
5.2. SO2 tác dụng với dung dịch kiềm
Tạo ra muối sunfit hoặc hidrosunfit hay cả hai loại
SO2 + NaOH → NaHSO3
SO2+ 2NaOH → Na2SO3 + H2O
5.3. Vừa là chất oxy hóa, vừa là chất khử
a) SO2 là chất khử
-
Phản ứng với chất oxy hóa mạnh
2SO2 + O2 → 2SO3 (V2O5, 450oC)
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
-
SO2 làm mất màu nước Brom
SO2 + Br2 + 2H2O → 2HBr + H2SO4
-
SO2 làm mất màu dung dịch thuốc tím
5SO2 + 2KMnO4 + 2H2O → K2SO4+ 2MnSO4 + 2H2SO4
b) SO2 chất oxy hoá mạnh
Tác dụng với chất khử mạnh
Phương trình phản ứng thể hiện tính oxi hóa của SO2 là
SO2 + 2H2S → 3S + 2H2O
SO2 + 2Mg → S + 2MgO
6. Tính chất hóa học của H2S
6.1. Tính axit yếu
- Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
- Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
6.2. Tính khử mạnh
- Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
- Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,...mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
- Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
- Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
- Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
7. Bài tập vận dụng
Câu 1. Cho các phản ứng sau:
(1) SO2 + 2H2S → 3S + 2H2O
(2) 5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
(3) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
(4) SO2 + Ca(OH)2 → Ca(HSO3)2
Số phản ứng mà SO2 đóng vai trò là chất khử là
A. 2. B. 1.
C. 3. D. 4.
Lời giải:
Đáp án: A
Phản ứng 2, 3 số oxi hóa của S tăng từ +4 lên +6 nên SO2 thể hiện tính khử.
Câu 2. Cặp khí nào sau đây không phân biệt được bằng dung dịch brom?
A. O2 và SO2. C. SO2 và CO2.
B. H2S và SO2. D. CO2 và H2S.
Lời giải:
Đáp án: B
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr
SO2 + Br2 + 2H2O → H2SO4 + 2HBr.
Câu 3. Khẳng định nào sau đây là đúng khi nói về tính chất hóa học của hiđro sunfua
A. Tính axit mạnh và tính khử yếu.
B. Tính bazơ yếu và tính oxi hóa mạnh.
C. Tính bazơ yếu và tính oxi hóa yếu.
D. Tính axit yếu và tính khử mạnh.
Lời giải:
Đáp án: D
Câu 4. Axit sunfuhiđric tác dụng với dung dịch bazơ KOH tạo 2 muối nào?
A. K2S2 và KHS
B. K2S2và K2S
C. K2S và KHS
D. KS và KHS
Lời giải:
Đáp án: C
Giải thích:
Axit sunfuhiđric tác dụng với dung dịch kiềm, tùy theo tỉ lệ sinh ra muối trung hòa hay muối axit
H2S + KOH → KHS + H2O
H2S + 2KOH → K2S + 2H2O
Câu 5. Khẳng định nào sau đây là đúng khi nói về tính chất hóa học của hiđro sunfua.
A. Tính axit mạnh và tính khử yếu.
B. Tính bazơ yếu và tính oxi hóa mạnh.
C. Tính bazơ yếu và tính oxi hóa yếu.
D. Tính axit yếu và tính khử mạnh.
Lời giải:
Đáp án: D
Câu 6. Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hoá - khử xảy ra.
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh.
C. Axit sunfuhiđric mạnh hơn axit sunfuric.
D. Axit sunfuric mạnh hơn axit sunfuhiđric.
Lời giải:
Đáp án: B
Câu 7. Có các lọ đựng hóa chất riêng rẽ: Na2S, NaCl, AgNO3, Na2CO3. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
A. dung dịch NaOH.
B. dung dịch H2SO4.
C. dung dịch HCl.
D. phenolphtalein.
Lời giải:
Đáp án: C
Câu 8. Trường hợp nào sau đây không xảy ra phản ứng hóa học?
A. 3O2 + 2H2S → 2SO2 + 2H2O (to)
B. FeCl2 + H2S → 2HCl + FeS
C. O3 + 2KI + H2O → 2KOH + O2 + I2
D. Cl2 + 2NaOH → NaCl + NaClO + H2O
Lời giải:
Đáp án: B
Câu 9. Cho phản ứng: SO2 + 2H2S → 3S + 2H2O. Câu nào diễn tả đúng tính chất của các chất?
A. SO2 bị oxi hóa và H2S bị khử.
B. SO2 bị khử và H2S bị oxi hóa.
C. SO2 khử H2S và không có chất nào bị oxi hóa.
D. SO2 bị khử, lưu huỳnh bị oxi hóa.
Lời giải:
Đáp án: B
Câu 10. Để nhận biết SO2 và SO3 người ta dùng thuốc thử:
A. dung dịch BaCl2
B. dung dịch NaOH
C. dung dịch H2SO4
D. dung dịch Ba(OH)2
Lời giải:
Đáp án: A
Giải thích:
Để phân biệt SO2 và SO3 có thể dùng dung dịch BaCl2. SO2 không hiện tượng còn SO3 tạo kết tủa trắng
SO3 + H2O → H2SO4
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
Câu 11. Để oxi hóa cùng một số mol H2S theo các phản ứng dưới đây (chưa cân bằng) thì trường hợp nào khối lượng chất oxi hóa cần dùng là lớn nhất?
A. H2S + O2 → S +H2O
B. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
C. H2S + Cl2 + H2O → H2SO4 + HCl
D. H2S + SO2 → S + H2O
Lời giải:
Đáp án: C
Giải thích:
Để oxi hóa cùng một số mol H2S theo các phản ứng dưới đây (chưa cân bằng) thì
H2S + Cl2 + H2O → H2SO4 + HCl
Câu 12. Trường hợp nào sau đây không xảy ra phản ứng hóa học?
A. 3O2 + 2H2S → 2H2O + 2SO2
B. FeCl2 + H2S → FeS + 2HCl
C. SO2 + 2H2S → 3S + 2H2O
D. SO3 + 2NaOH → Na2SO4 + H2O
Lời giải:
Đáp án: B
Câu 13. Cho V (lít) SO2 (đktc) hấp thụ hoàn toàn vào 100ml dung dịch NaOH 2M thu được hỗn hợp 2 muối có khối lượng là 16,7g
A. 3,36 lit
B. 1,87 lit
C. 4,48 lit
D. 1,12 lit
Lời giải:
Đáp án: A
Giải thích:
Phương trình hóa học
NaOH + SO2 → NaHSO3
NaOH + 2SO2 → Na2SO3 + H2O
Gọi x, y lần lượt số mol của 2 muối NaHSO3, Na2SO3
Bảo toàn nguyên tố Na có nNaHSO3 + 2.nNa2SO3= nNaOH => x + 2y = 0,2
mNaHSO3 + mNa2SO3= 16,7 <=> 104x + 126y = 16,7
=> x = 0,1; y = 0,05
Bảo toàn nguyên tố S có: nSO2 = nNaHSO3 + nNa2SO3= x + y = 0,1 + 0,05 = 0,15
=> V = 0,15.22,4 = 3,36 lit
Câu 14. Thực hiện thí nghiệm sau: cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Sau phản ứng có kết tủa trắng tạo thành
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh
C. Axit sunfuric mạnh hơn axit sunfuahidric
D. Axit sunfuahidric mạnh hơn axit sunfuaric
Lời giải:
Đáp án: B
Giải thích:
Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ: có kết tủa CuS tạo thành, không tan trong axit mạnh.
H2S + CuSO4→ CuS↓ (kết tủa đen) + H2SO4
=> Có kết tủa CuS tạo thành, không tan trong axit mạnh.
Câu 15. Để điều chế khí H2S người ta sử dụng hóa chất, phản ứng nào sau đây
A. Mg tác dụng với H2SO4 không quá đặc
B. FeS tác dụng với dung dịch HCl loãng
C. FeS tác dụng với dung dịch H2SO4 đặc
D. S tác dụng với H2
Lời giải:
Đáp án: B
Câu 16. Trộn 400 ml dung dịch NaOH 1M với 300ml dung dich H2SO4 1M. Hỏi sau khi phản ứng kết thúc khôi lượng muối thu được là bao nhiêu?
A. 19,1 gam
B. 9,55 gam
C. 38, 2 gam
D. 6,7 gam
Lời giải:
Đáp án: C
Giải thích:
Ta có: nNaOH = 0,4 .1 = 0,4 (mol); nH2SO4 = 0,3 mol
Phương trình phản ứng
NaOH + H2SO4 → NaHSO4 + H2O
(mol) 0,3 ← 0,3 → 0,3
NaOH + NaHSO4 → Na2SO4 + H2O
(mol) 0,1 → 0,1
⇒ nNaHSO4 dư = 0,3 – 0,1 = 0,2 (mol)
⇒ mmuối = mNaHSO4 + mNaSO4 = 120.0,2 + 142 .0,1= 38,2 gam
Câu 17. Khi pha loãng H2SO4 đặc thực hiện thao tác nào sau đây đúng:
A. Cho từ từ H2SO4 đặc vào nước và khuấy đều
B. Cho từ từ nước vào H2SO4đặc và khuấy đều
C. Cho nước và axit đồng thời vào cốc khuấy đều
D. Cho nhanh H2SO4 đặc vào nước và khuấy đều
Lời giải:
Đáp án: A
Câu 18. Cho 1,84 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10% thu được 1,12 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là:
A. 101,48g
B. 101,68g
C. 50.74g
D. 88,20g
Lời giải:
Đáp án: C
Giải thích:
Ta có: nH2SO4 = nH2 = 1,12/22,4 = 0,05 mol
→ mH2SO4 = 0,05 .98 = 4,9 gam → mdd H2SO4 = (4,9.100)/10 =49 gam
Áp dụng định luật bảo toàn khối lượng:
mhỗn hợp KL + mdd H2SO4 = mdd sau phản ứng + mH2
→ mdd sau phản ứng = mhỗn hợp KL + mdd H2SO4 - mH2 = 1,84 + 49 – 0,05. 2 = 50,74 g
Xem thêm các phương trình hóa học liên quan khác:
SO2 + Na2O → Na2SO3 | SO2 ra Na2SO3
SO2 + KOH → K2SO3 + H2O | SO2 ra K2SO3
SO2 + Ca(OH)2 → CaSO3 + H2O | SO2 ra CaSO3