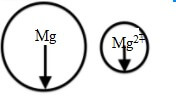
So sánh bán kính của Mg và Mg2+
1. So sánh
Bán kính nguyên tử magie lớn hơn bán kính ion Mg2+.
2. Giải thích
Ta có, cấu hình electron của ion Mg2+ là 1s2 2s2 2p6.
⇒ Nguyên tử kim loại Mg đã nhường 2 electron lớp ngoài cùng để hình thành cation Mg2+.
⇒ Bán kính của cation Mg2+ nhỏ hơn bán kính của nguyên tử Mg.
Giải thích: Cả nguyên tử Mg và ion Mg2+ đều có điện tích hạt nhân là 12+. Mà nguyên tử Mg có 12 electron còn cation Mg2+ có 10 electron nên hạt nhân của ion Mg2+ sẽ hút các electron mạnh hơn làm cho bán kính ion nhỏ hơn.
3. Ví dụ minh họa
Nhận xét nào sau đây là đúng?
A. Bán kính ion K+ lớn hơn bán kính nguyên tử K.
B. Bán kính nguyên tử Mg lớn hơn bán kính ion Mg2+.
C. Ion Na+ có 18 electron.
D. Bán kính của nguyên tử Al và ion Al3+ là bằng nhau.
Hướng dẫn giải
Đáp án đúng là: B
A sai, bán kính ion K+ nhỏ hơn bán kính nguyên tử K.
C sai, ion Na+ có 10 electron.
D sai, bán kính ion Al3+ nhỏ hơn bán kính nguyên tử Al
Xem thêm các bài viết về So sánh bán kính nguyên tử và bán kính ion hay và chi tiết khác:
So sánh bán kính của Cl và Cl-