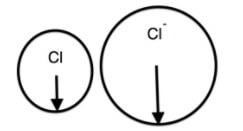
So sánh bán kính của Cl và Cl-
1. So sánh
Bán kính nguyên tử clo nhỏ hơn bán kính ion Cl-.
Hình minh họa:
2. Giải thích
Ta có, cấu hình electron của ion Cl- là 1s2 2s2 2p6 3s2 3p6.
⇒ Nguyên tử phi kim Cl đã nhận 1 electron để hình thành anion Cl-.
⇒ Bán kính của anion Cl- lớn hơn bán kính của nguyên tử Cl.
Giải thích:
+ Cả nguyên tử Cl và ion Cl- đều có điện tích hạt nhân là 17+ nhưng nguyên tử Cl có 17 electron còn anion Cl- có 18 electron.
+ Khi có thêm electron ở lớp ngoài cùng, ion clorua có xu hướng nở ra do lực đẩy điện tử giữa nhau. Điều này làm tăng bán kính ion clorua hơn bán kính nguyên tử clo.
3. Ví dụ minh họa
Nhận xét nào sau đây là đúng?
A. Bán kính ion Cl- lớn hơn bán kính nguyên tử clo.
B. Bán kính nguyên tử bao giờ cũng nhỏ hơn bán kính ion nguyên tử.
C. Ion Cl- có 18 proton.
D. Bán kính của nguyên tử Cl và ion Cl- là bằng nhau.
Hướng dẫn giải
Đáp án đúng là: A
A sai, ví dụ bán kính ion Na+ nhỏ hơn bán kính nguyên tử Na.
C sai, ion Cl- có 18 electron.
D sai, bán kính ion Cl- lớn hơn bán kính nguyên tử Cl.
Xem thêm các bài viết về So sánh bán kính nguyên tử và bán kính ion hay và chi tiết khác:
So sánh bán kính của Ca và Ca2+