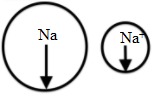
So sánh bán kính của Na và Na+
1. So sánh
Bán kính nguyên tử natri lớn hơn bán kính ion Na+.
2. Giải thích
Ta có, cấu hình electron của ion Na+ là 1s2 2s2 2p6.
⇒ Nguyên tử Na đã nhường 1 electron lớp ngoài cùng để hình thành ion Na+.
⇒ Bán kính của ion Na+ nhỏ hơn bán kính của nguyên tử Na.
Giải thích: Cả nguyên tử Na và ion Na+ đều có điện tích hạt nhân là 11+. Mà nguyên tử Na có 11 electron còn ion Na+ có 10 electron nên hạt nhân của ion Na+ sẽ hút các electron mạnh hơn làm cho bán kính ion nhỏ hơn.
3. Ví dụ minh họa
Nhận xét nào sau đây là đúng?
A. Bán kính ion K+ lớn hơn bán kính nguyên tử K.
B. Bán kính nguyên tử Na lớn hơn bán kính ion Na+.
C. Ion Na+ có 18 electron.
D. Bán kính của nguyên tử Al và ion Al3+ là bằng nhau.
Hướng dẫn giải
Đáp án đúng là: B
A sai, bán kính ion K+ nhỏ hơn bán kính nguyên tử K.
C sai, ion Na+ có 10 electron.
D sai, bán kính ion Al3+ nhỏ hơn bán kính nguyên tử Al
Xem thêm các bài viết về So sánh bán kính nguyên tử và bán kính ion hay và chi tiết khác: