Phương trình điện li HClO4
1. Viết phương trình điện li của HClO4
HClO4 → H+ + ClO4-
2. HClO4 là chất điện li mạnh
Chất điện li mạnh là một dung dịch/chất tan hoàn toàn hoặc gần như hoàn toàn trong nước, các phân tử hòa tan đều phân li ra ion.
Cùng với các axit như HCl, HNO3, H2SO4,… thì HClO4 cũng là một trong số những chất điện li mạnh. HClO4 là hợp chất rất dễ tan trong nước và tạo với nước các hidrat HClO4.nH2O (n = 1,2,3).
3. Bài tập vận dụng liên quan
Câu 1. Nước đóng vai trò gì trong quá trình điện li các chất tan trong nước?
A. Môi trường điện li.
B. Dung môi không phân cực.
C. Dung môi phân cực.
D. Tạo liên kết hiđro với các chất tan.
Lời giải:
Trong phân tử H2O, liên kết O−H là liên kết cộng hóa trị có cực, cặp e chung lệch về phía oxi
=> oxi tích điện âm, ở H tích điện dương.
Khi quá trình điện li xảy ra tương tác giữa các phân tử nước có cực và các ion chuyển động không ngừng làm cho các chất điện li dễ dàng tan trong nước
=> nước đóng vai trò dung môi phân cực.
Câu 2. Dung dịch chất nào sau đây không dẫn điện được?
A. HCl trong C6H6 (benzen).
B. CH3COONa trong nước.
C. Ca(OH)2 trong nước.
D. NaHSO4 trong nước.
Lời giải:
Dung dịch chất không dẫn điện được là: HCl trong C6H6 (benzen).
Câu 3. Dãy nào dưới dây chỉ gồm chất điện li mạnh?
A. HF, Na2S, Ca(OH)2, Na2CO3.
B. H2SO4, NaOH, NaCl, HF.
C. HNO3, H2SO4, KOH, K2SiO3.
D. Ba(OH)2, NaOH, CH3COOH, NaCl.
Lời giải:
Dãy chỉ gồm chất điện li mạnh: HNO3, H2SO4, KOH, K2SiO3.
HNO3 → H++ NO3−
H2SO4 ⇔ 2H+ + SO42-
KOH → K+ + OH−
K2SiO3→ 2K+ + SiO32-
Câu 4. Dãy chất nào sau đây, trong nước đều là chất điện li yếu?
A. HCl, H2SO3, H2SO4, HCl
B. H2CO3, H3PO4, CH3COOH, Ba(OH)2.
C. H2S, CH3COOH, HClO, HF
D. H2CO3, H2SO4, HClO, Fe2(SO4)3.
Lời giải:
Dãy chất trong nước đều là chất điện li yếu là H2S, CH3COOH, HClO, HF
H2S ⇄ H+ + HS−
HS− ⇆ H+ +S2−
CH3COOH ⇔ CH3COO– + H+
HClO ⇌ H+ + ClO–
HF ⇌ H+ + F–
Câu 5. Dãy các chất điện li mạnh?
A. AgCl, CH3COONa, HBr, NaOH.
B. NaCl, CH3COOH, HCl, NaOH.
C. NaCl, CH3COOH, HCl, Ca(OH)2.
D. CuSO4, H2S, H2SO4, KOH.
Lời giải:
A. Đúng
B,C Loại CH3COOH là chất điện li yếu
D. Loại H2S là chất điện li yếu
Câu 6. Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 400 ml dung dịch H2SO4 1M?
A. 0,2 lít
B. 0,1 lít
C. 0,4 lít
D. 0,8 lít
Lời giải:
nH2SO4= 0,4 (mol)
Phương trình điện li
H2SO4 → 2H+ + SO42-
nOH−= nH+ = 2nH2SO4= 2.0,4 = 0,8 (mol)
Phương trình điện li
Ba(OH)2 → Ba2+ + 2OH−
nBa(OH)2 =12nOH−= 12.0,8 = 0,4 (mol)
=> VBa(OH)2 = nCM= 0,40,5 = 0,8 (l)
Câu 7. Cho 14 gam Fe vào bình chứa 10,08 lít clo (đktc) tác dụng với nung nóng rồi lấy chất rắn thu được hoà vào nước và khuấy đều thì thu được 500 g dung dịch X. Nồng độ phần trăm của dung dịch X là
A. 6,35%.
B. 9,19%.
C. 8,125%.
D. 11,43%.
Lời giải:
Đáp án C
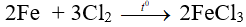
0,25 0,45 mol
Có
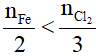
Vậy sau phản ứng clo dư; dung dịch thu được khi lấy chất rắn sau phản ứng vào nước là dung dịch FeCl3.
Câu 8. Cho 1,12 lít khí clo (đktc) vào dung dịch NaOH 1M, đến khi phản ứng xảy ra hoàn toàn thể tích dung dịch NaOH tối thiểu cần dùng là
A. 0,1 lít .
B. 0,15 lít.
C. 0,12 lít.
D. 0,3 lít.
Lời giải:
Đáp án A
nCl2= 0,05 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,05 → 0,1 mol
→VNaOH = 0,1 lit.
Xem thêm các phương trình hóa học liên quan khác:
Fe + Cl2 → FeCl3 | Fe ra FeCl3
SO2 + Cl2 + H2O → HCl + H2SO4 | SO2 ra H2SO4
H2S + Cl2 + H2O → H2SO4 + HCl | H2S ra H2SO4
KOH + Cl2 → KCl + KClO + H2O | KOH ra KCl | KOH ra KClO | Cl2 ra KCl | Cl2 ra KClO




