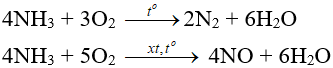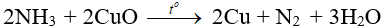Phản ứng NH3 + H2O → NH4OH
1. Phương trình phản ứng NH3 tác dụng H2O
NH3 + H2O → NH4OH
2. Tính bazơ yếu NH3
NH3 kết hợp với H+ của nước , tạo thành ion amoni NH4+, giải phóng OH- và dẫn điện
NH3 + H2O → NH4+ + OH-
Trong dung dịch, Amoniac là bazơ yếu. Có thể làm quỳ tím ẩm chuyển thành màu xanh.
3. Điều kiện phản ứng xảy ra
Nhiệt độ thường.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của NH3 (Amoniac)
Dung dịch Amoniac là một hợp chất có tính bazơ kém bền, nên mang đầy đủ tính chất hóa học của một bazơ yếu. Amoniac tan trong nước tạo thành cation amoni NH4+ và giải phóng anion OH-.
4.2. Bản chất của H2O (Nước)
NH3 là bazo yếu nên nước là môi trường lí tưởng để hoà tan.
5. Tính chất hóa học của NH3
5.1. Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
5.2. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
5.3. Tính khử
Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
- Tác dụng với oxi:
- Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
- Tác dụng với CuO:
6. Bài tập vận dụng liên quan
Câu 1. Muối nào dưới đây được dùng trong làm các loại bánh
A. (NH4)2CO3.
B. Na2CO3.
C. NH4HCO3
D. NH3Cl
Lời giải:
Câu 2. A là muối khi tác dụng với dung dịch KOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
A. (NH4)2CO3.
B. (NH4)2SO3.
C. NH4HSO4.
D. (NH4)3PO4.
Lời giải:
X + NaOH dư sinh ra khí mùi khai ⟹ khí mùi khai là NH3 ⟹ X có chứa muối amoni (NH4+)
X + BaCl2 sinh ra kết tủa không tan trong HNO3 ⟹ kết tủa này phải tạo bởi kim loại mạnh và gốc axit mạnh ⟹ kết tủa là BaSO4
Kết hợp với đáp án ⟹ X là: NH4HSO4
Phương trình hóa học
NH4HSO4 + 2NaOH → Na2SO4 + NH3↑ (mùi khai) + 2H2O
NH4HSO4 + BaCl2 → BaSO4↓ + NH4Cl + HCl
Câu 3. Cho 50 gam dung dịch NH4HSO4 5,75% vào 50 gam dung dịch Ba(OH)2 6,84% và đun nhẹ. Thể tích khí (đktc) và khối lượng kết tủa thu được là (giả sử toàn bộ khí sinh ra thoát ra khỏi dung dịch)
A. 2,24 lít và 3,3 gam
B. 2,24 lít và 8,64 gam
C. 0,672 lít và 4,66 gam
D. 1,792 lít và 4,64 gam.
Lời giải:
NH4HSO4 + Ba(OH)2 → BaSO4 ↓ + NH3 ↑ + H2O
HSO4- + Ba2+ → SO42- + H2O
OH- + NH4+ → NH3 + H2O
⇒ nNH3 = 0,03 mol
⇒ V = 0,03.22,4 = 0,672 lít
Ba2+ + SO42- → BaSO4
⇒ nBaSO4 = 0,02 mol
⇒ m = 0,02. 233= 4,66 gam
Câu 4. Nhận xét nào sau đây không đúng về muối amoni?
A. Muối amoni bền với nhiệt.
B. Các muối amoni đều là chất điện li mạnh.
C. Tất cả các muối amoni đều tan trong nước.
D. Các muối amoni đều bị thủy phân trong nước.
Lời giải:
Câu 5. Ở phản ứng nào sau đây NH3 đóng vai trò chất khử?
A. 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl
B. NH3 + HCl → NH4Cl
C. 2NH3 + H2SO4 → (NH4)2SO4
D. 2NH3 + 3CuO → N2 + 3Cu + 3H2O
Lời giải:
Câu 6. Dung dịch amoniac có thể hòa tan được Zn(OH)2 là do:
A. Do Zn(OH)2 là một bazo ít tan
B. Do Zn(OH)2 có khả năng tạo thành phức chất tan
C. Do Zn(OH)2 là một bazo lưỡng tính
D. Do amoniac là một hợp chất có cực và là một bazo yếu
Lời giải:
Câu 7. Hỗn hợp A gồm NH4Cl và (NH4)2SO4. Cho X tác dụng với dung dịch Ba(OH)2 dư, đun nhẹ thu được 4,66 gam kết tủa và 1,12 lít khí thoát ra. Hỗn hợp A có khối lượng là:
A. 5,280 gam.
B. 3,175 gam.
C. 5,350 gam.
D. 6,350 gam.
Lời giải:
Gọi số mol (NH4)2SO4, NH4Cl; lần lượt là x, y.
Phản ứng hóa học xảy ra:
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
x → x → 2x
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3 + 2H2O
y → y
Ta có chất kết tủa ở đây chính là BaSO4
mBaSO4 = 4,66
→ nBaSO4 = n(NH4)2SO4 = x = 4,66137+96= 0,02 mol
→ nNH3 = 2x + y =1,1222,4 = 0,05 mol
→ y = 0,01.
→mA = mNH4Cl + m(NH4)2SO4 = 53,5y + 132x = 3,175 gam
Câu 8.Oxi hóa 6 lít NH3 (tạo ra N2 và NO theo tỉ lệ mol 1 : 4) cần vừa đủ V là không khí ( chứa 20% oxi về thể tích). Các thể tích đó ở cùng điều kiện. Giá trị của V là
A. 6,5.
B. 22,5.
C. 32,5.
D. 24,5.
Lời giải:
Đáp án: C
12NH3 + 13O2 → 8NO + 2N2 + 18H2O
VO2 = (6 x 13) / 12 = 6,5 mol
⇒ Vkk = 6,5 : 20% = 32,5 lít
Câu 9. Cho 22,4 lít hỗn hợp khi X gồm N2 và H2 đi qua xúc tác Fe, nung nống để tổng hợp NH3 thu được 20,16 lít hỗn hợp khí Y. Hấp thụ toàn bộ Y vào dung dịch AlCl3 dư, thu được m gam kết tủa. Các thể tích khí đó ở cùng điều kiện. Giá trị của m là
A. 13.
B. 2,6.
C. 5,2.
D. 3,9.
Lời giải:
Đáp án: B
nX = 1 mol; nNH3 = nX - nY = 1- 0,9 = 0,1 mol
⇒ nAl(OH)3 = 0,1 /3 ⇒ m =2,6g
Xem thêm các phương trình hóa học khác:
NH3 + H2O → NH4OH | NH3 ra NH4OH
NH3 + O2 → NO + H2O | NH3 ra NO