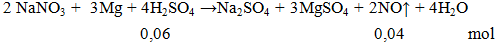Phản ứng NaNO3 + H2SO4 → HNO3 + NaHSO4
1. Trong phòng thí nghiệm thường điều chế HNO3 bằng phản ứng
NaNO3 + H2SO4 HNO3 + NaHSO4
2. Điều kiện phương trình phản ứng từ NaNO3 ra HNO3
Nhiệt độ
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của NaNO3 (Natri nitrat)
NaNO3 với phản ứng trao đổi khi đun hỗn hợp NaNO3 với H2SO4 đặc. Hơi HNO3 thoát ra được dẫn vào bình làm lạnh và ngưng tụ.
3.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là một axit mạnh tác dụng với muối tạo thành axit mới và muối mới.
4. Tiến hành thí nghiệm điều chế HNO3 trong phòng thí nghiệm
Để điều chế HNO3 trong phòng thí nghiệm, người ta cho muối natri nitrat tinh thể tác dụng với axit sunfuric đặc, chưng cất hỗn hợp này tại nhiệt độ sôi của axit nitric là 83oC cho đến khi còn lại chất kết tinh màu trắng theo phương trình như sau:
H2SO4 đặc + NaNO3(tinh thể) → HNO3 + NaHSO4
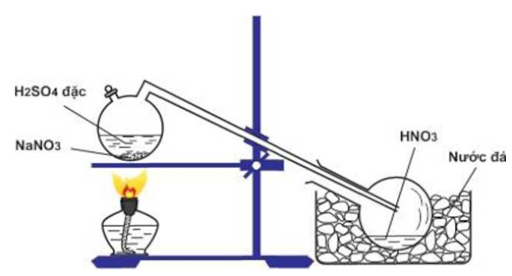
Axit nitric thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó.
5. Tính chất hoá học của H2SO4
5.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
5.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
6. Tính chất hoá học của NaNO3
- Natri nitrat thể hiện tính oxy hóa khử khi cho kẽm tác dụng với NaNO3 trong dd NaOH theo phương trình sau:
NaNO3 + 7NaOH + 4Zn → 2H2O + NH3 + 4Na2ZnO2
- NaNO3 diễn ra phản ứng trao đổi khi đun nóng hỗn hợp natri nitrat (NaNO3) với axit sunfuric (H2SO4) đặc. Phản ứng xảy ra, hơi HNO3 thoát ra sẽ được dẫn vào bình làm lạnh và ngưng tụ.
H2SO4 + NaNO3 → HNO3 + NaHSO4
- NaNO3 trong phương trình hóa học hữu cơ khi Cu tác dụng với H2SO4/NaNO3.
3Cu + 4H2SO4 + 2NaNO3 → 4H2O + Na2SO4 + 2NO + 3CuSO4
7. Bài tập vận dụng
Câu 1. Phát biểu nào sau đây là sai khi nói về quá trình điều chế Axit nitric?
A. Axit nitric có nhiệt độ sôi thấp ( 83oC) nên dễ bị bay hơi khi đun nóng.
B. Axit nitric là axit yếu hơn axit sufuric nên bị đẩy ra khỏi muối.
C. Axit nitric thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó.
D. Đốt nóng bình cầu bằng đèn cồn để phản ứng xảy ra nhanh hơn.
Lời giải:
Đáp án: B
Sai vì HNO3 là axit mạnh, bị đẩy ra khỏi dung dịch muối do tính dễ bay hơi của HNO3
Câu 2. Cho mẩu Mg vào ống nghiệm chứa dung dịch gồm NaNO3 và NaCl hiện tượng xảy ra là
A. Mẩu Mg tan dần, Na sinh ra bám vào magie.
B. Mẩu Mg tan dần, có khí không màu thoát ra.
C. Mẩu Mg tan dần, có khí nâu đỏ thoát ra.
D. Không xảy ra hiện tượng gì.
Lời giải:
Đáp án: D
Mg không phản ứng với NaNO3 và NaCl.
Câu 3. Trường hợp nào sau đây có phản ứng hóa học xảy ra?
A. Cho magie phản ứng với NaNO3.
B. Cho đồng phản ứng với Mg(NO3)2.
C. Cho magie phản ứng với hỗn hợp NaNO3 và H2SO4.
D. Cho đồng phản ứng với hỗn hợp NaNO3 và KCl.
Lời giải:
Đáp án: C
2NaNO3 + 3Mg + 4H2SO4 → Na2SO4 + 3MgSO4 + 2NO ↑ + 4H2O
Câu 4. Thể tích khí NO ở đktc thoát ra khi cho 1,44g Cu phản ứng hoàn toàn với dung dịch gồm NaNO3 và H2SO4 là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 0,896 lít.
Lời giải:
Đáp án: D
V = 0.04.22,4= 0,896 lít.
Câu 5. Thể tích khí NO ở đktc thoát ra khi cho 0,72g Mg phản ứng hoàn toàn với dung dịch gồm NaNO3 và HCl là
A. 1,12 lít.
B. 2,24 lít.
C. 0,448 lít.
D. 0,224 lít.
Lời giải:
Đáp án: C
Áp dụng định luật bảo toàn e có 3nNO = 2nMg = > nNO = 0,02 mol
V = 0.02.22,4= 0,448 lít.
Câu 6. Cho mẩu Al vào ống nghiệm chứa dung dịch gồm NaNO3 và K2SO4 hiện tượng xảy ra là
A. Mẩu Al tan dần, K sinh ra.
B. Mẩu Al tan dần, có khí không màu thoát ra.
C. Mẩu Al tan dần, có khí nâu đỏ thoát ra.
D. Không xảy ra hiện tượng gì.
Lời giải:
Đáp án: D
Al không phản ứng với NaNO3 và K2SO4.
Câu 7. Cho Al vào dung dịch chứa NaNO3 và H2SO4 thấy thu được khí N2. Tổng hệ số cân bằng (tối giản) của chất tham gia phản ứng là
A. 6.
B. 32.
C. 34.
D. 36.
Lời giải:
Đáp án: C
6NaNO3 + 10Al + 18H2SO4 → 3Na2SO4 + 5Al2(SO4)3 + 3N2 ↑+ 18H2O
Xem thêm các phương trình hóa học khác:
NH4NO3 ra NH3 | NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O | Fe2O3 ra Fe2(SO4)3
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O l FeSO4 ra Fe2(SO4)3