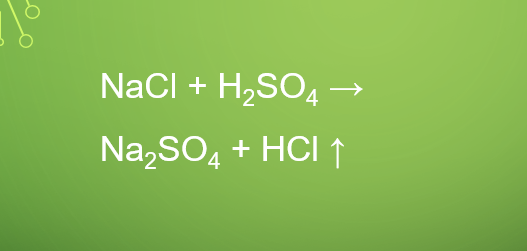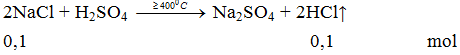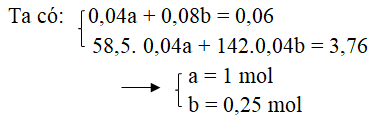NaCl + H2SO4 → Na2SO4 + HCl ↑
1. Phản ứng hóa học giữa NaCl và H2SO4
2NaCl + H2SO4 ≥ 400oC→ Na2SO4 + 2HCl ↑
2. Điều kiện phản ứng
- Nhiệt độ trên 400oC
3. Cách thực hiện phản ứng
- Cho tinh thể NaCl tác dụng với H2SO4 đặc và đun nóng (≥ 400oC)
4. Hiện tượng nhận biết phản ứng
- Có khí thoát ra.
5. Mở rộng tính chất của H2SO4
Ở trạng thái loãng là một axit mạnh, ở trạng thái đặc là một chất ôxihóa mạnh.
5.1. Ở dạng loãng là axít mạnh
- Làm đỏ quì tím, tác dụng kim loại (trước H2) giải phóng H2, tác dụng bazơ, oxit bazơ và nhiều muối.
H2SO4 làm quỳ tím hóa đỏ
Fe + H2SO4 → FeSO4 + H2
NaOH + H2SO4 → NaHSO4 + H2O
CuO + H2SO4 → CuSO4 + H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
Na2 CO3 + H2SO4 → Na2SO4 + H2O + CO2
5.2. Ở dạng đặc là một chất oxi hóa mạnh
Tác dụng với kim loại: oxi hoá hầu hết các kim loại (trừ Au và Pt) tạo muối hoá trị cao và thường giải phóng SO2 (có thể H2 S, S nếu kim loại khử mạnh như Mg ).
2 Fe + 6H2SO4 
Cu + 2H2SO4 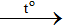
Al, Fe, Cr không tác dụng với H2SO4 đặc nguội, vì kim loại bị thụ động hóa.
- Tác dụng với phi kim ( tác dụng với các phi kim ở dạng rắn, to) tạo hợp chất của phim kim ứng với số oxh cao nhất.
C + 2H2SO4 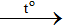
S + 2H2SO4 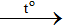
- Tác dụng với một số chất có tính khử
FeO + H2SO4 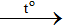
HBr + H2SO4 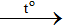
- Hút nước của 1 số chất hữu cơ:
C12H22O11 + H2SO4(đ) → 12C + H2SO4.11H2O
6. Bạn có biết
- Đây là phương pháp sunfat, dung điều chế HCl trong phòng thí nghiệm.
7. Ví dụ minh họa
Ví dụ 1: Khí hidro clorua có thể được điều chế bằng cách cho KCl rắn tác dụng với chất nào sau đây?
A. H2SO4 loãng. B. H2SO4 đặc.
C. NaOH. D. H2O.
Hướng dẫn giải
Khí hidro clorua có thể được điều chế bằng cách cho KCl rắn tác dụng với H2SO4 đặc.
Đáp án B.
Ví dụ 2: Khi cho NaCl phản ứng với H2SO4 đặc ở 400oC thu được sản phẩm muối là
A. Na2SO4. B. NaHSO4. C. Na2SO3. D. NaHSO3.
Hướng dẫn giải
2NaCl + H2SO4 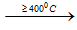
Đáp án A.
Ví dụ 3: Thể tích khí HCl ở đktc thu được khi cho 5,85 gam NaCl phản ứng với H2SO4 đặc ở 400oC là
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít.
Hướng dẫn giải
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
8. Bài tập vận dụng liên quan (có đáp án)
8.1. Trắc nghiệm
Câu 1. Phản ứng nào sau đây được dùng để điều chế khí hiđro clorua trong phòng thí nghiệm?
A. H2 + Cl2 → 2HCl
B. Cl2 + H2O → HCl + HClO
C. Cl2 + SO2 + 2H2O → 2HCl + H2SO4
D. NaClrắn + H2SO4 đặc → NaHSO4 + HCl
Lời giải:
Đáp án D
Câu 2: Dung dịch H2SO4 loãng có thể tác dụng với cả 2 chất nào sau đây?
A. Cu và Cu(OH)2. B. Fe và Fe(OH)3.
C. C và CO2. D. S và H2S.
Lời giải:
Đáp án B
Fe + H2SO4 (l) → FeSO4 + H2
2Fe(OH)3 + 3H2SO4 (l) → Fe2(SO4)3 + 6H2O
Câu 3: H2SO4 đặc khi tiếp xúc với đường, vải, giấy có thể làm chúng hóa đen do tính chất nào dưới đây?
A. Oxi hóa mạnh. B. Háo nước.
C. Axit mạnh. D. Khử mạnh.
Lời giải:
Đáp án B
Câu 4. Dung dịch A chứa đồng thời axit HCl và H2SO4. Để trung hòa 40 ml A cần dùng vừa hết 60 ml NaOH 1M. Cô cạn dung dịch khi trung hòa, thu được 3,76 g hỗn hợp muối khan. Vậy nồng độ mol/l của hai axit HCl và H2SO4 là:
A. 1 và 0,75 B. 0,25 và 1 C. 0,25 và 0,75 D. 1 và 0,25
Lời giải:
Đáp án: D
Gọi a, b là nồng độ mol của HCl và H2SO4
HCl + NaOH → NaCl + H2O
0,04a 0,04a 0,04a
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,04b 0,08b 0,04b
Câu 5: Cho 20 gam hỗn hợp Cu và Al phản ứng với dung dịch H2SO4 loãng, dư thấy thu được 13,44 lít khí (đktc). % theo khối lượng Al và Cu trong hỗn hợp lần lượt là
A. 44% và 66%. B. 54% và 46%.
C. 50% và 50%. D. 94% và 16%.
Lời giải:
Đáp án B
Cu không phản ứng
Bảo toàn e → 3.nAl = 2.nkhí → nAl = 0,4
%mAl = 54%.
8.2. Tự luận
Bài 1: Điện phân nóng chảy một muối 11,7g halogenua NaX người ta thu được 2,24 lít khí (đktc).
a) Xác định nguyên tố X ?
b) Tính thế tích khí HX thu được khi cho X tác dụng với 4,48 lít H2 ở đktc ?
c) Tính tỷ lệ % các khí sau phản ứng ?
Lời giải:
PTHH: 2NaX → 2Na + X2
a, nX2 = 0,1 mol ⇒ nNaX = 2. 0,1 = 0,2 mol.
MNaX = 11,7/0,2 = 58,5 ⇒ X = 35,5 (Cl)
b, X2 + H2 → 2HX
nH2 = 0,2 mol ⇒ nHX = 2. nX2= 0,2 mol (H2 dư)
⇒ VHX = 0,2.22,4 = 4,48 l
c, Sau phản ứng có 0,2 mol khí HCl và 0,1 mol H2 dư
%HCl= 0,2/(0,2 + 0,1)= 66,67%
⇒ %H2 = 33,33%
Bài 2. Cho 0,896 lít Cl2 tác dụng với 200 ml dung dịch NaOH 1M ở to thường thu được dung dịch X. Tính CM của các chất trong dung dịch X ?
Lời giải:
Cl2 + 2NaOH → NaCl + NaClO + H2O
nCl2 = 0,896/22,4 = 0,04 mol
nNaOH = 0,2 mol
Theo pt ⇒ nNaCl = nNaClO = nCl2 =0,04 mol
⇒ CMNaCl = CMNaClO = 0,04/0,2 = 0,2M
nNaOHdư = 0,2 – 0,04.2 = 0,12 mol ⇒ CMNaOH = 0,12 / 0,2 = 0,6M
Bài 3. Trộn 200 ml dung dịch NaOH 1M với 150ml dung dich H2SO4 1M. Hỏi sau khi phản ứng kết thúc khôi lượng muối thu được là bao nhiêu?
Lời giải:
Ta có: nNaOH = 0,2 × 1 = 0,2(mol); nH2SO4 = 0,15 mol
Phản ứng: NaOH + H2SO4 → NaHSO4 + H2O
(mol) 0,15 ← 0,15 → 0,15
NaOH + NaHSO4 → Na2SO4 + H2O
(mol) 0,05 → 0,05
⇒ nNaHSO4 dư = 0,15 – 0,05 = 0,1 (mol)
⇒ mmuối = mNaHSO4 + mNaSO4 = 120 × 0,1 + 142 × 0,05=19,1(gam)
Xem thêm các phương trình hóa học hay khác:
NaCl + H2O → NaOH + Cl2 + H2 | NaCl ra NaOH
BaCl2 + H2SO4 → BaSO4 + HCl | H2SO4 ra BaSO4
H2SO4 + KCl → HCl + K2SO4 | KCl ra HCl