Phản ứng Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
1. Phương trình phản ứngH2SO4 ra SO2
Na2SO3+ H2SO4 → Na2SO4 + SO2↑ + H2O
2. Điều kiện phản ứng Na2SO3 ra SO2
Nhiệt độ thường
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Na2SO3 (Natri sunfat)
Khi Na2SO3 tiếp xúc với axit, Na2SO3 trải qua quá trình phân hủy, giải phóng SO2.
3.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là axit mạnh tác dụng với muối.
4. Cách tiến hành điều chế SO2 trong phòng thí nghiệm
Trong phòng thí nghiệm, khí SO2 được điều chế bằng cách cho muối sunfit là muối của axit yếu tác dụng với axit mạnh hơn thường là dung dịch axit sunfuric với muối natri sunfit.
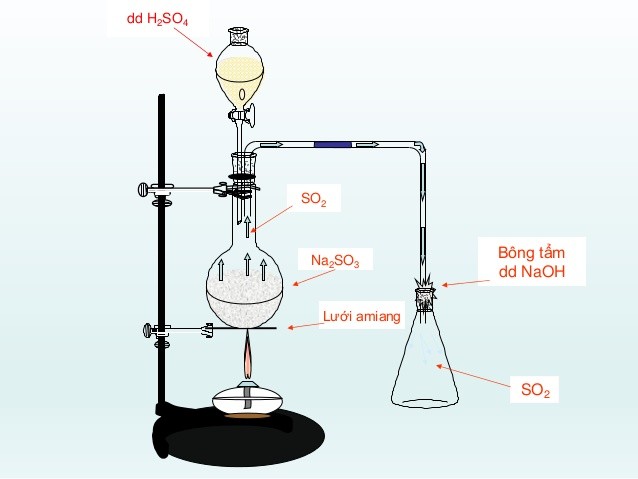
5. Hiện tượng nhận biết phản ứng điều chế lưu huỳnh đioxit
Có khí không màu, mùi hắc thoát ra.
Thu khí lưu huỳnh dioxit bằng phương pháp chuyển không khí. Dùng bông tẩm dung dịch natri hidroxit NaOH để hạn chế lượng khí SO2 thoát ra ngoài. Không dùng bông tẩm khí amoniac NH3 vì nó là khí dễ bay hơi khiến việc thu khí không đạt hiệu quả cao.
6. Tính chất hoá học của H2SO4
6.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
6.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
7. Ứng dụng của H2SO4
- Trong sản xuất phân bón: Axit sunfuric được dùng chính trong để sản xuất axit photphoric, một nguyên liệu không thể thiếu để sản xuất các loại phân photphat. Và nó cũng được dùng để sản xuất Amoni sunfat.
- Trong sản xuất công nghiệp: H2SO4 được sử dụng rộng rãi trong sản xuất kim loại như đồng, kẽm,... và dùng để làm sạch bề mặt thép và dung dịch tẩy gỉ.
Axit sunfuric còn được dùng để sản xuất nhôm sunfat (phèn làm giấy), các loại muối sunfat, chế tạo thuốc nổ, thuốc nhuộm, chất dẻo, tẩy rửa kim loại trước mạ, sản xuất dược phẩm.
Hỗn hợp H2SO4 với nước được dùng làm chất điện giải trong các dạng ắc quy, axit chì,...
- Trong xử lí nước thải: Axit sunfuric được sử dụng để sản xuất nhôm hidroxit, chất được dùng trong các nhà máy xử lý nước để lọc tạp chất, cải thiện mùi vị của nước, trung hòa độ pH trong nước, loại bỏ các Ca2+, Mg2+, có trong nước thải.
- Trong phòng thí nghiệm: Axit sunfuric là hợp chất đậm đặc dùng để điều chế các axít khác yếu hơn: HNO3. HCl ở trong thí nghiệm.
Là hóa chất không thể thiếu trong các phản ứng để đưa ra những kết quả, ứng dụng vào trong các lĩnh vực khác của cuộc sống.
8. Bài tập vận dụng
Câu 1. Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây:
A. cồn.
B. muối ăn.
C. xút.
D. giấm ăn
Lời giải:
Đáp án: C
Giải thích:
Để hạn chế khí SO2 bay ra, người ta sử dụng bông tẩm xút vì xút có khả năng phản ứng:
SO2 + 2NaOH → Na2SO3 + H2O
Câu 2. Dãy chất nào sau đây tác dụng được với Khí SO2
A. BaO, K2SO4, Ca(OH)2
B. KOH, CaO, H2O
C. Ca(OH)2, H2O, BaCl2
D. KCl, H2O, CaO
Lời giải:
Đáp án: B
Câu 3. Hòa tan V lít khí SO2 (đktc) vào 100 ml dung dịch NaOH 1,2M thì thu được 10,02 gam hỗn hợp hai muối. Tìm giá trị của V
A. 2,016 lít.
B. 1,344 lít.
C. 0,672 lít.
D. 2,24 lít.
Lời giải:
Đáp án: A
Câu 4. SO2 là một trong những khí gây ô nhiễm môi trường là do
A. SO2 là chất có mùi hắc, nặng hơn không khí.
B. SO2 vừa có tính khử, vừa có tính oxi hóa.
C. SO2 là khí độc, tan trong nước mưa tạo thành axit gây ra sự ăn mòn kim loại.
D. SO2 là một oxit axit mạnh
Lời giải:
Đáp án: C
SO2 là một trong những khí gây ô nhiễm môi trường là do SO2 là khí độc, tan trong nước mưa tạo thành axit gây ra sự ăn mòn kim loại.
Câu 5. Phản ứng được dùng để điều chế SO2 trong công nghiệp là
A. Na2SO3+ H2SO4 → Na2SO4 + SO2↑ + H2O.
B. Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2 + 2H2O.
C. 4FeS2 + 11O2 → 8SO2 + 2Fe2O3.
D. C + 2H2SO4 đặc → 2SO2+ CO2 + 2H2O.
Lời giải:
Đáp án: C
Câu 6. Dùng hóa chất nào sau đây để nhận biết hai khí SO2 và SO3
A. dung dịch Br2
B. dung dịch NaOH
C. dung dịch nước vôi trong
D. Dung dịch BaCl2
Lời giải:
Đáp án: D
Câu 7. Nhận xét nào sau đây không đúng về SO2?
A. khí này làm mất màu dung dịch nước brom và dung dịch thuốc tím.
B. Phản ứng được với H2S tạo ra S.
C. Liên kết trong phân tử là liên kết cộng hóa trị có cực
D. Được tạo ra khi sục khí O2 vào dung dịch H2S.
Lời giải:
Đáp án: D
Câu 8. Cho các sơ đồ phản ứng sau:
(1) MnO2 + HCl → khí X;
(2) FeS + HCl → khí Y;
(3) Na2SO3 + HCl → khí Z;
(4) NH4HCO3 + NaOH (dư) → khí G.
Những khí sinh ra tác dụng được với NaOH là
A. Y, Z, G.
B. X, Y, G.
C. X, Z, G.
D. X, Y, Z.
Lời giải:
Đáp án: D
Giải thích:
(1) MnO2+ 4HCl → MnCl2 + Cl2 (X) + 2H2O
(2) FeS + 2HCl → FeCl2 + H2S (Y)
(3) Na2SO3 + 2HCl → 2NaCl + SO2 (Z) + H2O
(4) NH4HCO3 + 2NaOH (dư) → Na2CO3 + NH3(G) + 2H2O
=> những khí tác dụng được với NaOH là: Cl2 (X), H2S (Y), SO2 (Z)
Câu 9. Trung hòa vừa đủ 250ml dung dịch Ba(OH)2 1M với dung dịch H2SO4 15%. Khối lượng dung dịch H2SO4 đã dùng là:
A. 163,3 gam
B. 326,6 gam
C. 217,7 gam
D. 312,6 gam
Lời giải:
Đáp án: A
Giải thích:
nBa(OH)2 = 0,25 mol
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
0,25 0,25 mol
Khối lượng H2SO4 đã dùng là:
mddH2SO4 = (0,25.98).100%/15% = 163,3 gam
Câu 10. Cho dung dịch chứa các ion sau: Na+, Ca2+, Mg2+, Ba2+, H+, NO3-. Muốn tách được nhiều cation ra khỏi dung dịch mà không đưa ion lạ vào dung dịch người ta dùng:
A. Dung dịch K2CO3 vừa đủ .
B. Dung dịch Na2SO4 vừa đủ.
C. Dung dịch KOH vừa đủ.
D. Dung dịch Na2SO3 vừa đủ.
Lời giải:
Đáp án: D
Xem thêm các phương trình hóa học hay khác:
S + H2SO4 → SO2 + H2O l H2SO4 ra SO2 | S ra SO2Ba(OH)2 + H2SO4 → BaSO4 + H2O | H2SO4 ra BaSO4
BaCl2 + H2SO4 → BaSO4 + HCl | H2SO4 ra BaSO4




