Trắc nghiệm Hóa 10 Dạng 3. Tính biến thiên enthalpy phản ứng theo năng lượng liên kết có đáp án
-
324 lượt thi
-
12 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
Cho phản ứng hóa học sau:
CH4 (g) + Cl2 (g) → CH3Cl (g) + HCl (g)
Biết năng lượng liên kết (kJmol-1) trong các chất cho ở bảng sau:
|
C – H |
Cl – Cl |
C – Cl |
H – Cl |
|
414 |
243 |
339 |
431 |
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
\[{\Delta _r}H_{298}^0 = 1 \times {E_b}(C{H_4}) + 1 \times {E_b}(C{l_2}) - 1 \times {E_b}(C{H_3}Cl) - 1 \times {E_b}(HCl)\]
= 1 × 4EC – H + 1 × ECl – Cl – 1 × (3EC – H + EC – Cl) – 1 × EH – Cl
= 1 × 4 × 414 + 1 × 243 - 1×(3×414 + 339) - 1×431 = -113 (kJ).
Câu 2:
Cho phản ứng hóa học sau:
3H2 (g) + N2 (g) → 2NH3 (g)
Biết năng lượng liên kết (kJmol-1) trong các chất như sau:
|
H – H |
N ≡ N |
N – H |
|
432 |
945 |
391 |
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết là
\[{\Delta _r}H_{298}^0 = 3 \times {E_b}({H_2}) + {E_b}({N_2}) - 2 \times {E_b}(N{H_3})\]
= 3 × Eb (H – H) + Eb (N ≡ N) – 2 × 3 × Eb (N – H)
= 3 × 432 + 945 - 2 × 3 × 391 = -105 kJ.
Câu 3:
Cho phản ứng sau:
H2 (g) + Cl2 (g) → 2HCl (g)
Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Biến thiên enthalpy chuẩn của phản ứng là:
\[\begin{array}{l}{\Delta _r}H_{298}^0 = {E_b}_{(H - H)} + {E_{b(Cl - Cl)}} - 2{E_{b(H - Cl)}}\\ = 436 + 243 - 2.432 = - 185(kJ).\end{array}\]
Câu 4:
Cho phản ứng hóa học sau:
2H2(g) + O2(g) 2H2O(g)
Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb(H-H) = 432 kJ/mol; Eb(O=O) = 498 kJ/mol; Eb(O-H) = 467 kJ/mol.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Biến thiên enthalpy chuẩn của phản ứng là
\({\Delta _r}H_{298}^o = {\rm{ }}2.{E_b}\left( {{H_2}} \right){\rm{ }} + {\rm{ }}{E_b}\left( {{O_2}} \right){\rm{ }}--{\rm{ }}2.{E_b}\left( {{H_2}O} \right)\)
= 2.Eb(H-H) + Eb(O=O) – 2.2.Eb(O-H) = 2.432 + 498 – 2.2.467 = -506 (kJ).
Câu 5:
Cho phản ứng hóa học sau:
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g)
Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb(C-C) = 347 kJ/mol; Eb(C-H) = 413 kJ/mol; Eb(O=O) = 498 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(O-H) = 467 kJ/mol.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Biến thiên enthalpy chuẩn của phản ứng là
\({\Delta _r}H_{298}^o = {\rm{ }}{E_b}\left( {{C_7}{H_{16}}} \right){\rm{ }} + {\rm{ }}11.{E_b}\left( {{O_2}} \right){\rm{ }}--{\rm{ }}7.{E_b}\left( {C{O_2}} \right){\rm{ }}--{\rm{ }}8.{E_b}\left( {{H_2}O} \right)\)
= 6.Eb(C-C) + 16Eb(C-H) + 11.Eb(O=O) – 7.2.Eb(C=O) – 8.2.Eb(O-H)
= 6.347 + 16.413 + 11.498 – 7.2.745 – 8.2.467 = -3734 kJ.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
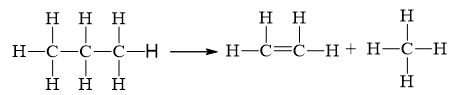
\({\Delta _r}H_{298}^o = 2.{E_b}_{\left( {C{\rm{ }}--{\rm{ }}C} \right)}{\rm{ }} + {\rm{ }}8.{E_b}_{\left( {C{\rm{ }}--{\rm{ }}H} \right)} - 1.{E_b}_{\left( {C{\rm{ }} = {\rm{ }}C} \right)}{\rm{ - }}8.{E_b}_{\left( {C{\rm{ }}--{\rm{ }}H} \right)}\)
= 2.346 + 8.418 - 1.612 - 8.418 = +80 kJ.
Câu 7:
Cho phản ứng hóa học sau:
H2C=CH2(g) + H2(g) → H3C-CH3(g)
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
C = C |
H - H |
|
Eb (kJ/mol) |
418 |
346 |
612 |
436 |
Biến thiên enthalpy chuẩn của phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
\({\Delta _r}H_{298}^o = {\rm{ }}{E_{C = C}} + {\rm{ }}4.{E_{C - H}} + {\rm{ }}{E_{H - H}}--{\rm{ }}{E_{C - C}}--{\rm{ }}6{E_{C - H}}\)
= EC=C + EH-H – EC-C – 2EC-H = 612 + 436 – 346 – 2.418 = -134 (kJ).
Câu 8:
Cho phản ứng tạo thành propene từ propyne:
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
C = C |
C ≡ C |
H - H |
|
Eb (kJ/mol) |
413 |
347 |
614 |
839 |
432 |
Biến thiên enthalpy chuẩn của phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
\[{\Delta _r}H_{298}^0 = {E_b}_{\left( {C \equiv C} \right)} + {E_b}_{\left( {C - C} \right)} + 4.{E_b}_{\left( {C - H} \right)} + {E_b}_{\left( {H - H} \right)} - {E_b}_{\left( {C = C} \right)} - {E_b}_{\left( {C - C} \right)} - 6.{E_b}_{\left( {C - H} \right)}\]
= Eb (C≡C) – Eb(C=C) + Eb(H-H) – 2Eb(C-H)
= 839 – 614 + 432 – 2.413 = -169 kJ.
Câu 9:
Cho phản ứng đốt cháy octane như sau:
C8H18 (g) + \[\frac{{25}}{2}{O_2}(g)\]→ 8CO2 (g) + 9H2O (l) \[{\Delta _r}H_{298}^0 = - 5030\,kJ\]
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
O = O |
C = O |
H - O |
|
Eb (kJ/mol) |
414 |
347 |
498 |
799 |
x |
Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ta có:
\[{\Delta _r}H_{298}^0 = {E_b}({C_8}{H_{18}}) + \frac{{25}}{2}{E_b}({O_2}) - 8{E_b}(C{O_2}) - 9{E_b}({H_2}O)\]\[ \Leftrightarrow - 5030 = {\rm{ }}7{E_{C - C}} + {\rm{ }}18{E_{C{\rm{ }}--{\rm{ }}H}} + \frac{{25}}{2}{E_{O = O}} - 8.2.{E_{C = O}} - 9.2.{E_{O - H}}\]
\[ \Leftrightarrow - 5030 = {\rm{ }}7.347{\rm{ }} + {\rm{ }}18.414{\rm{ }} + \frac{{25}}{2}.498 - 16.799 - 18x\]
Þ x = 464
Câu 10:
Cho phản ứng tổng quát: aA + bB → mM + nN. Hãy chọn phương án tính đúng \[{\Delta _r}H_{298}^o\] của phản ứng:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Cách tính enthalpy của phản ứng hoá học dựa vào năng lượng liên kết:
\[{\Delta _r}H_{298}^0 = \sum\limits_{}^{} {{E_b}} \left( {c{\rm{d}}} \right) - \sum\limits_{}^{} {{E_b}\left( {sp} \right)} \]
Hay \[{\Delta _r}H_{298K}^o = a \times {E_b}\left( A \right) + b \times {E_b}\left( B \right) - m \times {E_b}\left( M \right) - n \times {E_b}\left( N \right)\]
- Cách tính enthalpy của phản ứng hoá học dựa vào enthalpy tạo thành:
\[{\Delta _r}H_{298}^0 = \sum\limits_{}^{} {{\Delta _f}H_{298}^0} \left( {sp} \right) - \sum\limits_{}^{} {{\Delta _f}H_{298}^0\left( {cd} \right)} \]
Hay \[{\Delta _r}H_{298K}^o = m \times {\Delta _f}H_{298}^o\left( M \right) + n \times {\Delta _f}H_{298}^o\left( N \right) - a \times {\Delta _f}H_{298}^o\left( A \right) - b \times {\Delta _f}H_{298}^o\left( B \right)\]
Câu 11:
Phosgene (COCl2) được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than hoạt tính. Biết ở điều kiện chuẩn: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(C ≡ O) = 1075 kJ/mol. Biến thiên enthalpy chuẩn của phản ứng tạo thành phosgene từ CO và Cl2 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Áp dụng công thức:
\[{\Delta _r}H_{298}^0 = {E_b}(CO) + {E_b}(C{l_2}) - {E_b}(COC{l_2})\]
= EC≡O + ECl – Cl – EC=O – 2EC – Cl
= 1075 + 243 – 745 – 2.339 = - 105 kJ.
Câu 12:
Cho phương trình hóa học của phản ứng:
\[{C_2}{H_4}\left( g \right) + {H_2}O\left( l \right) \to {C_2}{H_5}OH\left( l \right)\]
Công thức tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành chuẩn của các chất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phản ứng: \[{C_2}{H_4}\left( g \right) + {H_2}O(l){\rm{ }} \to {C_2}{H_5}OH\left( l \right)\]
Biến thiên enthalpy của phản ứng tính theo nhiệt tạo thành chuẩn:
\[{\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0\left( {{C_2}{H_5}OH} \right){\rm{ }} - {\Delta _f}H_{298}^0\left( {{C_2}{H_4}} \right){\rm{ }} - {\Delta _f}H_{298}^0\left( {{H_2}O} \right)\]
