Đề kiểm tra kì 2 Hóa học 10 CTST có đáp án - Đề 1
-
261 lượt thi
-
31 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 2:
Cho các phát biểu sau:
(a) Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
(b) Số oxi hoá của kim loại kiềm trong hợp chất là +1.
(c) Số oxi hoá của oxygen trong OF2 là -2.
(d) Trong hợp chất, hydrogen luôn có số oxi hoá là +1.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 4:
 Xem đáp án
Xem đáp án
Câu 5:
Cho phương trình nhiệt hóa học của phản ứng:
CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s) \[{\Delta _r}H_{298}^o = - 231,04kJ\]
Phản ứng trên là phản ứng
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 8:
 Xem đáp án
Xem đáp án
Câu 9:
Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^o\) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
 Xem đáp án
Xem đáp án
Đáp án: A
\({\Delta _r}H_{298}^o\)= \({\rm{[}}{\Delta _f}H_{298}^o(C{O_2}(g)) + {\Delta _f}H_{298}^o({H_2}O(l)).2{\rm{]}}\) - \({\rm{[}}{\Delta _f}H_{298}^o(C{H_4}(g)) + {\Delta _f}H_{298}^o({O_2}(g)).2{\rm{]}}\)
⇒ – 890,3 = [(– 393,5) + (– 285,8.2)] – [\({\Delta _f}H_{298}^o(C{H_4}(g))\) + 0.2]
⇒ \({\Delta _f}H_{298}^o(C{H_4}(g))\)= – 74,8 kJ.
Câu 10:
Cho phản ứng sau:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 12:
Cho phản ứng hoá học:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Sau 40 giây, nồng độ của HCl giảm từ 0,6M về 0,4M. Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là
 Xem đáp án
Xem đáp án
Đáp án: C
Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là
\[\overline v = - \frac{1}{2}.\frac{{(0,4 - 0,6)}}{{40}} = 2,5 \times {10^{ - 3}}(M/s).\]
Câu 13:
Cho phản ứng đơn giản sau:
CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g)
Biểu thức tốc độ tức thời của phản ứng viết theo định luật tác dụng khối lượng là
 Xem đáp án
Xem đáp án
Đáp án: A
Câu 15:
 Xem đáp án
Xem đáp án
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án: A
Áp dụng công thức:
\( \Rightarrow {v_2} = {v_1} \times {2^{\frac{{40 - 70}}{{10}}}} = {2^{ - 3}}{v_1} = \frac{1}{8}{v_1}\)
Như vậy khi nhiệt độ giảm từ 70oC xuống 40oC thì tốc độ phản ứng giảm 8 lần.
Câu 18:
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 22:
Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa.
(b) Hydrofluoric acid là acid yếu.
(c) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 29:
Lập phương trình hoá học của phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron (chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử).
a) 
b) KI + H2SO4 → I2 + H2S + K2SO4 + H2O
 Xem đáp án
Xem đáp án
Đáp án:
a) ![]()
Cl2 vừa là chất khử, vừa là chất oxi hoá.
Ta có các quá trình:
Quá trình oxi hoá: \[{\mathop {Cl}\limits^0 _2} \to 2\mathop {Cl}\limits^{ + 5} \,\, + 10e\]
Quá trình khử: \[{\mathop {Cl}\limits^0 _2} + 2e \to 2\mathop {Cl}\limits^{ - 1} \]
Phương trình được cân bằng:
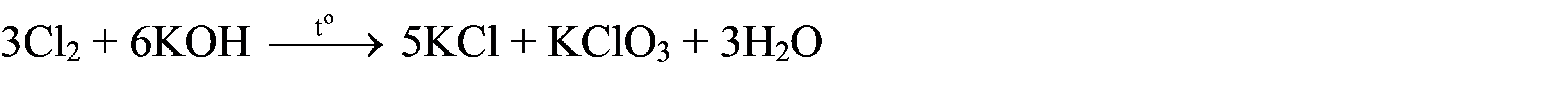
b) \[K\mathop {I{\rm{ }}}\limits^{ - 1} + {\rm{ }}{H_2}\mathop S\limits^{ + 6} {O_4} \to {\rm{ }}{\mathop I\limits^0 _2} + {\rm{ }}{H_2}\mathop S\limits^{ - 2} {\rm{ }} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}{H_2}O\]
Chất khử: KI.
Chất oxi hoá: H2SO4.
Quá trình oxi hoá: \[2\mathop I\limits^{ - 1} \to {\mathop I\limits^0 _2} + 2e\]
Quá trình khử: \[\mathop S\limits^{ + 6} + 8e \to \mathop S\limits^{ - 2} \]
Phương trình được cân bằng:
8KI + 5H2SO4 → 4I2 + H2S + 4K2SO4 + 4H2O
Câu 30:
Cho nhiệt độ sôi của các halogen như sau:
|
Halogen |
F2 |
Cl2 |
Br2 |
I2 |
|
Nhiệt độ sôi (oC) |
-188 |
-35 |
59 |
184 |
Giải thích sự biến đổi nhiệt độ sôi từ fluorine đến iodine.
 Xem đáp án
Xem đáp án
Đáp án:
Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals dẫn đến nhiệt độ sôi tăng.
Câu 31:
 Xem đáp án
Xem đáp án
Đáp án:
nB = \[\frac{{0,4958}}{{24,79}}\]= 0,02 mol
Gọi số mol MgCO3 là x (mol), số mol Zn là y (mol).
Phương trình hoá học:
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
x 2x x x mol
Zn + 2HCl → ZnCl2 + H2
y 2y y y mol
Ta có hệ phương trình:
\[\left\{ \begin{array}{l}{m_x} = 1,49g\\{n_B} = 0,02mol\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}84x + 65y = 1,49\\x + y = 0,02\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}x = 0,01\\y = 0,01\end{array} \right.\]
\[\% {m_{MgC{O_3}}} = \frac{{0,01.84}}{{1,49}}.100\% = 56,38\% .\]
%mZn = 100% – 56,38% = 43,62%.
