Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Chân trời sáng tạo có đáp án (Đề 1)
-
315 lượt thi
-
31 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hóa học là ngành khoa học thuộc lĩnh vực khoa học tự nhiên, nghiên cứu về thành phần, cấu trúc, tính chất và sự biến đổi của chất cũng như ứng dụng của chúng.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu C không đúng vì hạt electron có khối lượng rất nhỏ so với hạt proton.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số đơn vị điện tích hạt nhân nguyên tử (còn gọi là số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
Câu 4:
Cho những nguyên tử của các nguyên tố sau:
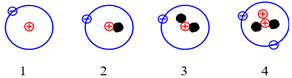
Những nguyên tử nào sau đây là đồng vị của nhau?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Đồng vị là những nguyên tử có cùng số proton nhưng khác nhau về số neutron dẫn đến số khối của chúng là khác nhau.
Vậy các nguyên tử (1); (2); (3) là đồng vị của nhau do cùng có số proton là 1.
Câu 5:
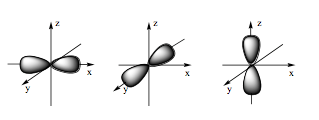
Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
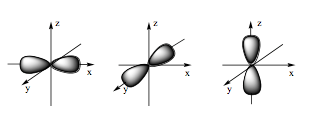
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Orbital p có dạng hình số tám nổi.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Lớp K, lớp thứ nhất, gần hạt nhân nhất, liên kết chặt chẽ với hạt nhân nhất.
Câu 7:
Nguyên tử nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của X: 1s22s22p63s23p2.
Viết gọn: [Ne]3s23p2.
Câu 8:
Ở trạng thái cơ bản, nguyên tử aluminium (Al) có số electron độc thân là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron Al theo ô orbital:
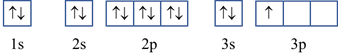
Số electron độc thân của nguyên tử Al ở trạng thái cơ bản: 1 electron.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số hiệu nguyên tử của nguyên tố hóa học bằng số thứ tự của ô nguyên tốCâu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chu kì 4 của bảng hệ thống tuần hoàn có 18 nguyên tố.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong các nhóm A, sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại lặp lại giống như chu kì trước (biến đổi tuần hoàn) là do sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện thường tăng dần.
Câu 13:
Cho các nguyên tố O (Z = 8), F (Z = 9), Si (Z = 14), S (Z = 16). Nguyên tố có tính phi kim lớn nhất trong số các nguyên tố trên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
|
|
Nhóm IVA |
Nhóm VIA |
Nhóm VIIA |
|
Chu kì 2 |
|
O (Z = 8) |
F (Z = 9) |
|
Chu kì 3 |
Si (Z = 14) |
S (Z = 16) |
|
Theo quy luật biến đổi ta có tính phi kim: Si < S < O < F.
Vây nguyên tố có tính phi kim lớn nhất trong dãy là F.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp áp đúng là: C
X thuộc nhóm IA nên có hóa trị cao nhất trong hợp chất là I.
Công thức oxide ứng với hóa trị cao nhất của X là X2O.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron.
X ở nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Cấu hình electron của X là: 1s²2s²2p63s².
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
X thuộc nhóm IA nên có 1 electron ở lớp ngoài cùng.
Z thuộc nhóm VIIA nên có 7 electron ở lớp ngoài cùng.
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố X, Z lần lượt là ns1 và ns2np5.Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
O (Z = 8): 1s22s22p4
Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận vào 2 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất.
Câu 19:
Khi nguyên tử nhận electron sẽ tạo thành
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi nguyên tử nhận electron sẽ tạo thành phần tử mang điện âm (gọi là anion).
Câu 20:
Chất nào sau đây là hợp chất ion?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
K2O: hợp chất ion;
SO2; CO2; HCl: hợp chất cộng hóa trị.
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết cộng hoá trị thường được hình thành giữa các nguyên tử nguyên tố phi kim với nhau.
Câu 22:
Cho các hợp chất sau: Na2O; H2O; HCl; Cl2; O3; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị phân cực?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các chất trong phân tử chứa liên kết cộng hóa trị phân cực là: H2O; HCl.
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
|
Công thức phân tử |
Công thức cấu tạo |
Số lượng cặp electron chung |
|
O2 |
O = O |
2 |
|
N2 |
N ≡ N |
3 |
|
F2 |
F - F |
1 |
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
X thuộc nhóm VIIA, là phi kim mạnh.
Liên kết giữa X với hydrogen là liên kết cộng hóa trị phân cực (có cực).
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết trong phân tử Cl2 được hình thành nhờ sự xen phủ bên p – p.
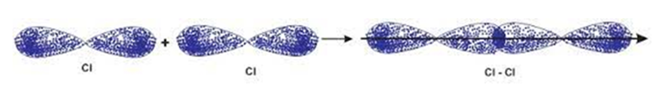
Câu 26:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các chất NH4Cl; CO có liên kết cho nhận.
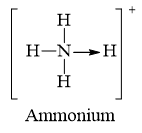
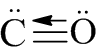
Carbon monoxide
Câu 27:
Cho các phát biểu sau
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các phát biểu (a) và (c) đúng.
Câu 28:
Chất nào sau đây không thể tạo được liên kết hydrogen?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
Vậy CH4 không thể tạo được liên kết hydrogen.
Câu 29:
Viết cấu hình electron của các ion: K+, Mg2+, F–, S2–. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
 Xem đáp án
Xem đáp án
- Cấu hình electron K+: 1s22s22p63s23p6 Þ giống cấu hình electron của khí hiếm argon.
- Cấu hình electron Mg2+: 1s22s22p6 Þ giống cấu hình electron của khí hiếm neon.
- Cấu hình electron F–: 1s22s22p6 Þ giống cấu hình electron của khí hiếm neon.
- Cấu hình electron S2–: 1s22s22p63s23p6 Þ giống cấu hình electron của khí hiếm argon.
Câu 30:
Dựa vào giá trị độ âm điện, dự đoán loại liên kết (liên kết cộng hóa trị phân cực, liên kết cộng hóa trị không phân cực, liên kết ion) trong các phân tử: MgCl2, AlCl3, HBr, O2, H2 và NH3.
|
Nguyên tử |
Mg |
Al |
H |
N |
Cl |
Br |
O |
|
Độ âm điện |
1,31 |
1,61 |
2,20 |
3,04 |
3,16 |
2,96 |
3,44 |
 Xem đáp án
Xem đáp án
- MgCl2: Δχ = 3,16 − 1,31 = 1,85 > 1,7 ⇒ liên kết ion.
- AlCl3: 0,4<Δχ = 3,16 − 1,61 = 1,55 < 1,7 ⇒ liên kết cộng hóa trị phân cực.
- HBr: 1,7>Δχ = 2,96 − 2,20 = 0,76 > 0,4 ⇒ liên kết cộng hóa trị phân cực.
- O2, H2 liên kết cộng hóa trị không phân cực do được hình thành từ hai nguyên tử giống nhau.
- NH3: 1,7>Δχ = 3,04 − 2,20 = 0,84 > 0,4 ⇒ liên kết cộng hóa trị phân cực.
Câu 31:
 Xem đáp án
Xem đáp án
Khi đi từ F2 đến I2, do khối lượng các phân tử tăng dần làm tương tác van der Waals giữa các phân tử halogen cũng tăng dần, nên fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
