Giải Sách bài tập Hóa học 10 Bài 10: Liên kết ion
KCl, Na2CO3, (NH4)2SO4, BaCO3, AgCl, BaSO4, KMnO4.
Lời giải:
Chú ý:
- Ion đơn nguyên tử là ion được tạo nên từ một nguyên tử, ví dụ: Cl-; Na+ …
- Ion đa nguyên tử là ion được tạo nên từ nhiều nguyên tử liên kết với nhau để thành một nhóm nguyên tử mang điện tích dương hoặc âm, ví dụ: NH4+; SO42- …
Vậy:
+ Hợp chất tạo nên bởi các ion đơn nguyên tử: KCl; AgCl.
+ Hợp chất tạo nên bởi ion đơn nguyên tử và đa nguyên tử: Na2CO3, BaCO3, BaSO4, KMnO4.
+ Hợp chất tạo nên bởi các ion đa nguyên tử: (NH4)2SO4.
A. 2.
B. 3.
C. 4.
D. vô số hợp chất.
Lời giải:
Đáp án đúng là: C
Các hợp chất chứa hai loại ion có thể tạo thành từ các ion này là: NaF; Na2CO3; CaF2; CaCO3.
A. Nitrogen và oxygen.
B. Carbon và hydrogen.
C. Sulfur và oxygen.
D. Calcium và oxygen.
Lời giải:
Đáp án đúng là: D
Liên kết ion được tạo thành giữa kim loại điển hình và phi kim điển hình.
Vậy liên kết giữa calcium và oxygen là liên kết ion.
A. Là hợp chất ion.
B. Có công thức hoá học là NaO.
C. Trong điều kiện thường, tồn tại ở thể khí.
D. Trong điều kiện thường, tồn tại ở thể rắn.
E. Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
G. Có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
H. Lực tương tác giữa Na+ và O2- là lực tĩnh điện.
Lời giải:
Đáp án đúng là: A, D, E, H
B sai vì công thức hóa học là Na2O.
C sai vì hợp chất này ở thể rắn trong điều kiện thường.
G sai vì hợp chất này có nhiệt độ nóng chảy và nhiệt độ sôi cao.
A. Bằng nhau.
B. Bán kính của O lớn hơn của O2-.
C. Bán kính của O nhỏ hơn của O2-.
D. Không dự đoán được.
Lời giải:
Đáp án đúng là: C
Bán kính của O nhỏ hơn bán kính của O2- do khi nhận thêm electron thì lực đẩy giữa các electron tăng lên, làm giảm lực hút giữa hạt nhân với các electron dẫn đến electron ở xa hạt nhân hơn.
A. Bằng nhau.
B. Bán kính của Al lớn hơn của Al3+.
C. Bán kính của Al nhỏ hơn của Al3+.
D. Không dự đoán được.
Lời giải:
Đáp án đúng là: B
Bán kính của Al lớn hơn bán kính của Al3+ do khi hình thành cation, nguyên tử sẽ mất bớt electron, lực hút của hạt nhân với các electron tăng lên, electron sẽ ở gần hạt nhân hơn.
|
Cột A |
Cột B |
|
a) S b) Al c) F d) Mg |
1. điện tích 2+ 2. điện tích 3+ 3. điện tích 2 – 4. điện tích 1 – |
Lời giải:
- a ghép với 3, giải thích:
S có 6 electron ở lớp ngoài cùng, có xu hướng nhận thêm 2 electron để tạo thành ion S2-. Vậy điện tích của ion là 2 –.
- b ghép với 2, giải thích:
Al có 3 electron ở lớp ngoài cùng, có xu hướng nhường đi 3 electron để tạo thành ion Al3+. Vậy điện tích của ion là 3+.
- c ghép với 4, giải thích:
F có 7 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron để tạo thành ion F-. Vậy điện tích của ion là 1 –.
- d ghép với 1, giải thích:
Mg có 2 electron ở lớp ngoài cùng, có xu hướng nhường đi 2 electron để tạo thành ion Mg2+. Vậy điện tích của ion là 2+.
Bài 10.8 trang 29 SBT Hóa học 10: Chọn phương án đúng để hoàn thành câu sau:
Khi hình thành các hợp chất ion, ...(1)... mất các electron hoá trị của chúng để tạo thành ...(2)... mang điện tích dương và ...(3)... nhận các electron hoá trị để tạo thành ...(4)... mang điện tích âm.
A. (1) kim loại, (2) anion, (3) phi kim, (4) cation.
B. (1) phi kim, (2) cation, (3) kim loại, (4) anion.
C. (1) kim loại, (2) ion đa nguyên tử, (3) phi kim, (4) anion.
D. (1) phi kim, (2) anion, (3) kim loại, (4) cation.
E. (1) kim loại, (2) cation, (3) phi kim, (4) anion.
Lời giải:
Đáp án đúng là: E
Khi hình thành các hợp chất ion, (1) kim loại mất các electron hoá trị của chúng để tạo thành (2) cation mang điện tích dương và (3) phi kim nhận các electron hoá trị để tạo thành (4) anion mang điện tích âm.
Bài 10.9 trang 29 SBT Hóa học 10: Điền từ thích hợp vào chỗ trống:
Lời giải:
Barium thuộc nhóm IIA, iodine thuộc nhóm VIIA, hợp chất của hai nguyên tố này là hợp chất (1) ion. Ở điều kiện thường, hợp chất này tồn tại ở thể (2) rắn với cấu trúc tinh thể tạo nên bởi (3) Ba2+ và (4) I-.
Lời giải:
Giai đoạn 1: Hình thành ion trái dấu theo quy tắc octet từ các quá trình kim loại (Ca) nhường electron và phi kim (F) nhận electron.
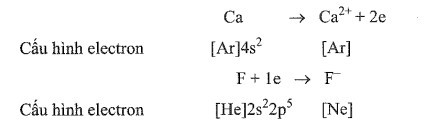
Giai đoạn 2: Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion:
Ca2+ + 2F- → CaF2.
Gợi ý: Nếu các tiểu phân hút nhau sẽ giải phóng năng lượng, đẩy nhau sẽ hấp thu năng lượng.
Lời giải:
Sau khi được hình thành, các cation và anion sẽ hút nhau bởi lực hút tĩnh điện rất mạnh để tạo thành hợp chất ion, quá trình này giải phóng nhiều năng lượng (thậm chí dư thừa để bù cho các quá trình đã hấp thu năng lượng trước đó, chẳng hạn như năng lượng để phá vỡ liên kết Cl – Cl).
a) LiCl và NaCl
b) Na2O và MgO.
Lời giải:
a) Khi hình thành hợp chất LiCl thì năng lượng tỏa ra là nhiều hơn. Giải thích:
Do khi tạo thành hợp chất LiCl hay NaCl thì đều đi từ các cation có điện tích 1+ và anion có điện tích 1-, nhưng bán kính của Li+ nhỏ hơn của Na+ nên lực hút tĩnh điện giữa Li+ với Cl- sẽ mạnh hơn và tỏa nhiều năng lượng hơn so với Na+.
b) Khi hình thành hợp chất MgO thì năng lượng tỏa ra là nhiều hơn. Giải thích:
Do khi tạo thành Na2O thì cation mang điện tích 1+ (Na+) còn khi tạo thành MgO thì cation mang điện tích 2+ (Mg2+) nên lực hút giữa Mg2+ với O2- sẽ mạnh hơn nhiều so với Na+ và O2-, do đó năng lượng tỏa ra khi tạo thành MgO cũng nhiều hơn.
Xem thêm lời giải sách bài tập Hóa học lớp 10 Cánh diều với cuộc sống hay, chi tiết khác:
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học




