Giải SBT Hóa học 11 Bài 17: Phenol
Bài 17.1 trang 53 SBT Hóa học 11: Chất nào sau đây là chất rắn ở điều kiện thường?
A. Phenol. B. Ethanol. C. Toluene. D. Glycerol.
Lời giải:
Đáp án đúng là: A
Phenol là chất rắn ở điều kiện thường.
Bài 17.2 trang 53 SBT Hóa học 11: Phenol không phản ứng với chất nào sau đây?
A. NaHCO3. B. Na. C. NaOH. D. Br2.
Lời giải:
Đáp án đúng là: A
Phenol không phản ứng với NaHCO3.
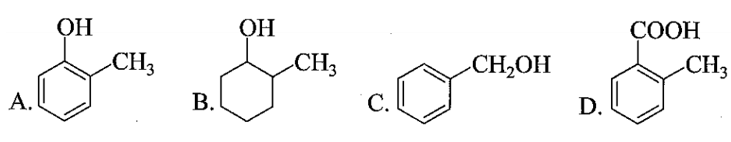
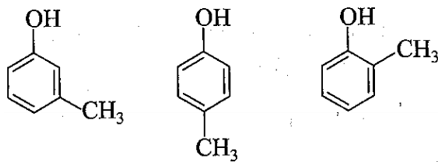
Bài 17.3 trang 53 SBT Hóa học 11: ">Trong các chất sau, chất nào thuộc loại phenol?
Lời giải:
Đáp án đúng là: A
Phenol là những hợp chất hữu cơ trong phân tử có một hay nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
Bài 17.4 trang 53 SBT Hóa học 11: Chất nào sau đây tác dụng với NaOH theo tỉ lệ mol 1 : 1?
Lời giải:
Đáp án đúng là: C
Vì chất C thuộc loại monophenol.
A. Giấm (dung dịch có acetic acid).
B. Dung dịch NaCl.
C. Nước chanh (dung dịch có citric acid).
D. Xà phòng có tính kiềm nhẹ.
Lời giải:
Đáp án đúng là: D
Vì phenol có tính acid yếu nên cần sử dụng xà phòng có tính kiềm nhẹ để trung hòa acid.
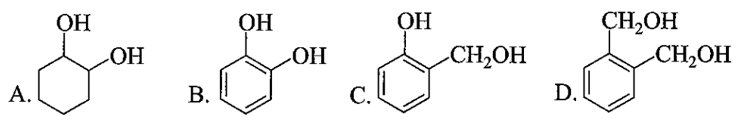
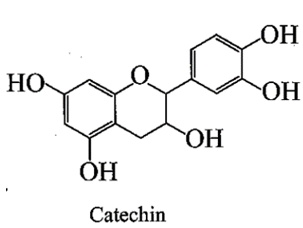
Phát biểu nào sau đây là không đúng?
A. Công thức phân tử của catechin là C15H14O6.
B. Phân tử catechin có 5 nhóm OH phenol.
C. Catechin phản ứng được với dung dịch NaOH.
D. Catechin thuộc loại hợp chất thơm.
Lời giải:
Đáp án đúng là: B
Phân tử catechin chỉ có 4 nhóm OH phenol, nhóm OH còn lại là alcohol.
A. 10,5. B. 7,0. C. 14,0. D. 21,0.
Lời giải:
Đáp án đúng là: B
Trong hỗn hợp X chỉ phenol phản ứng với NaOH.
⇒ Số mol phenol là: 0,5.0,1 = 0,05 (mol)
Hỗn hợp X phản ứng hoàn toàn với Na dư, thu được 1 239,5 mL khí H2
⇒ Số mol ethanol là: − 0,05 = 0,05 (mol)
Vậy m = 0,05.94 + 0,05.46 = 7,0 (gam)
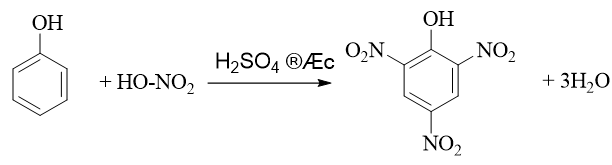
a) Viết phương trình hoá học của phản ứng điều chế picric acid từ phenol.
b) Giải thích vì sao trong phòng thí nghiệm thường bảo quản picric acid trong lọ dưới một lớp nước và trong quá trình làm việc với picric acid, tránh để acid tiếp xúc với kim loại?
Lời giải:
a) Phương trình hoá học:
b) Phân tử picric acid dễ gây cháy, nổ mạnh nên để an toàn, thường bảo quản picric acid trong lọ dưới một lớp nước. Mặt khác, picric acid có tính acid mạnh, phản ứng với kim loại toả nhiệt, tạo muối picrate cũng dễ gây cháy nổ.
a) Tìm công thức phân tử của A.
b) Cho một lượng chất A vào ống nghiệm đựng nước, thấy A không tan. Thêm tiếp dung dịch NaOH vào ống nghiệm, khuấy nhẹ, thấy A tan dần. Tìm công thức cấu tạo có thể có của A.
c) Chất B (phân tử có vòng benzene) là một trong số các đồng phân của A. Chất B không tác dụng với Na, không tác dụng với NaOH. Tìm công thức cấu tạo và gọi tên B.
Lời giải:
a) Đặt công thức của A là CxHyO.
Khối lượng mol của A là: = 108 (g mol–1).
x = = 7; y = = 8.
Vậy công thức phân tử của A là C7H8O.
b) Thí nghiệm chứng tỏ A không tan trong nước, A tác dụng với NaOH, vậy A là phenol. Công thức cấu tạo của A là một trong số ba công thức cấu tạo sau:
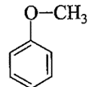
c) Chất B là một trong số các đồng phân (có vòng benzene) của A. Chất B không tác dụng với Na, không tác dụng với NaOH nên B là methyl phenyl ether:
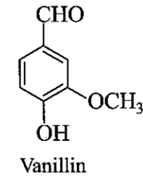
a) Viết công thức phân tử của vanillin.
b) Dự đoán khả năng tan trong nước, trong ethanol và trong dung dịch kiềm như NaOH, KOH của vanillin.
c) Mẫu vanillin đủ tiêu chuẩn dùng trong công nghiệp sản xuất dược phẩm và thực phẩm cần có trên 99% về khối lượng là vanillin. Để định lượng một mẫu vanillin, người ta làm như sau: Hoà tan 0,120 gam mẫu trong 20 mL ethanol 96% và thêm 60 mL nước cất, thu được dung dịch X. Biết X phản ứng vừa đủ với 7,82 mL dung dịch NaOH nồng độ 0,1 M và tạp chất trong mẫu không phản ứng với NaOH. Mẫu vanillin trên có đủ tiêu chuẩn dùng trong công nghiệp sản xuất dược phẩm và thực phẩm không?
Lời giải:
a) Công thức phân tử của vanillin: C8H8O3.
b) Vanillin khó tan trong nước, dễ tan trong ethanol, tan trong dung dịch kiềm.
c) Số mol NaOH là: = 7,82 .10–4 (mol)
HOC6H3(OCH3)(CHO) + NaOH → NaOC6H3(OCH3)(CHO) + H2O
Số mol vanillin C8H8O3 bằng số mol NaOH và bằng 7,82.10–4 mol.
Phần trăm khối lượng vanillin trong mẫu trên là: = 99,05%.
Mẫu vanillin trên đủ tiêu chuẩn dùng trong công nghiệp sản xuất dược phẩm và thực phẩm.
a) Viết phương trình hoá học của phản ứng xảy ra khi đun nóng hỗn hợp chlorobenzene và dung dịch NaOH đặc, dư ở nhiệt độ 300oC, áp suất 200 bar.
b) Lập sơ đồ điều chế phenol từ benzene và các chất vô cơ.
c) Tính khối lượng benzene cần thiết để điều chế được 9,4 kg phenol theo sơ đồ ở phần b), biết hiệu suất của cả quá trình là 42%.
Lời giải:
a) Phương trình hoá học:
b) Sơ đồ điều chế phenol từ benzene và các chất vô cơ.
c) Khối lượng benzene cần thiết là: = 18,57 (kg).
Xem thêm các bài giải SBT Hóa học lớp 11 Cánh diều hay, chi tiết khác: