Phản ứng FeSO4 + NaOH → Fe(OH)2 + Na2SO4
1. Phương trình phân tử phản ứng NaOH + FeSO4
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
2. Phương trình ion rút gọn FeSO4 + NaOH
Fe2+ + 2OH- → Fe(OH)2 ↓
3. Hiện tượng khi cho FeSO4 tác dụng NaOH
Khi cho dung dịch FeSO4 vào ống nghiệm đựng sẵn NaOH, thấy xuất hiện kết tủa màu trắng xanh, sau đó kết tủa xanh chuyển sang kết tủa có màu nâu đỏ.
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của FeSO4 (Sắt sunfat)
FeSO4 mang đầy đủ tính chất hóa học của muối nên tác dụng được với dung dịch kiềm.
4.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh tác dụng được với muối.
5. Mở rộng kiến thức về FeSO4
5.1. Tính chất vật lí và nhận biết
- Tính chất vật lý: Có khả năng hút ẩm tốt, thường tồn tại ở trạng thái ngậm nước. Tan tốt trong nước cho dung dịch không màu.
- Nhận biết: Sử dụng dung dịch BaCl2, thấy xuất hiện kết tủa trắng:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
5.2. Tính chất hóa học
- Mang đầy đủ tính chất hóa học của muối.
- Có tính khử và tính oxi hóa:
Tính khử: Fe2+ → Fe3+ + 1e
Tính oxi hóa: Fe2+ + 1e → Fe
a. Tính chất hóa học của muối:
- Tác dụng với dung dịch kiềm:
FeSO4 + KOH → K2SO4 + Fe(OH)2
- Tác dụng với muối:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
b. Tính khử:
FeSO4 + Cl2 → FeCl3 +Fe2(SO4)3
2FeSO4 + 2H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + 2H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
c. Tính oxi hóa:
FeSO4 + Mg → MgSO4 + Fe
5.3. Điều chế
- Cho kim loại Fe dư tác dụng với axit HNO3
3Fe + 8HNO3 → 4H2O + 2NO + 3Fe(NO3)2
6. Mở rộng về tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
6.1. Phản ứng với axit tạo thành muối + nước
NaOHdd + HCldd→ NaCldd + H2O
6.2. Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
6.3. Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit
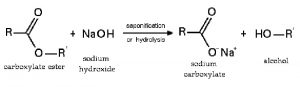
6.4. Phản ứng với muối tạo bazo mới + muối mới
(điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
6.5. Tác dụng với kim loại lưỡng tính
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
6.6. Tác dụng với hợp chất lưỡng tính
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
7. Dạng bài tập vận dụng liên quan (có đáp án)
Câu 1. Cho dung dịch NaOH dư vào dung dịch FeSO4 và Fe2(SO4)3, thu được kết tủa X. Cho X tác dụng với dung dịch HNO3 dư thu được dung dịch chứa muối
A. Fe(NO3)2 và NaNO3.
B. Fe(NO3)3.
C. Fe(NO3)3 và NaNO3.
D. Fe(NO3)2.
Lời giải:
Kết tủa X gồm
X + HNO3 dư Muối Fe(NO3)3.
Câu 2. Cho 100ml dung dịch FeSO40,5 M Phản ứng với NaOH dư. Sau Phản ứng lọc lấy kết tủa rồi đem nung trong không khí đến khi khối luợng không đổi. Khối lượng chất rắn thu được sau khi nung là:
A. 4,0 gam
B. 3,6 gam
C. 4,5 gam
D. 6,2 gam
Lời giải:
Ta có sơ đồ:
FeSO4 Fe(OH)2 Fe2O3
Bảo toàn e:
Câu 3. Cho 13,4 gam hỗn hợp A gồm CaCO3 và MgCO3 vào dung dịch HCl vừa đủ, thoát ra 3,36 lít khí (đktc) và dung dịch B chứa a gam muối clorua. Giá trị của m là
A. 30,1.
B. 31,7.
C. 15,09.
D. 31.9,
Lời giải:
2H+ + CO32- → CO2+ H2O
nCl- = nH+ = 2nCO2 = 0,3 mol
m = mX – mCO32- + mCl- = 13,4 – 0,15.60 + 0,3.35,5 = 15,09 gam
Câu 4. Khi cho dung dịch NaOH vào dung dịch FeSO4 hiện tượng xảy ra là
A. Xuất hiện kết tủa màu trắng xanh
B. Xuất hiện kết tủa màu nâu đỏ
C. Xuất hiện kết tủa màu trắng xanh rồi chuyển sang kết tủa màu nâu đỏ.
D. Xuất hiện kết tủa màu nâu đỏ rồi chuyển sang kết tủa màu trắng xanh
Lời giải:
Câu 5. Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. Al(OH)3 và NaOH
B. HNO3 và KHCO3
C. NaAlO2 và KOH
D. KCl và AgNO3
Lời giải:
Xem thêm các phương trình hóa học khác:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O l FeSO4 ra Fe2(SO4)3
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O | K2Cr2O7 ra Cr2(SO4)3
FeS + H2SO4 → FeSO4 + H2S | FeS ra FeSO4




