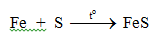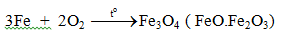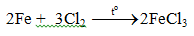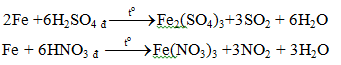Phản ứng Fe + HNO3 → Fe(NO3)3 + N2O + H2O
1. Phương trình phản ứng giữa Fe và HNO3 đặc
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
2. Điều kiên phản ứng xảy ra Fe và HNO3 đặc
Nhiệt độ thường
3. Cách cân bằng phương trình Fe + HNO3 → Fe(NO3)3 + N2O + H2O
Xác định số oxi hóa của các nguyên tố thay đổi
Fe0 + HN+5O3 → Fe+3(NO3)3+ N+12O + H2O
|
8x 3x |
Fe0 → Fe3+ + 3e 2N+5 + 8e → N2+1 |
Vậy ta có phương trình: 8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O↑ + 15H2O
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Fe (Sắt)
- Trong phản ứng trên Fe là chất khử.
- Fe là kim loại tác dụng được với các axit HNO3, H2SO4 đặc.
4.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
5. Tính chất hóa học của Fe
Sắt là kim loại có tính khử trung bình, tùy theo các chất oxi hóa mà sắt có thể bị oxi hóa lên mức +2 hay +3.
Fe → Fe2+ + 2e
Fe → Fe3+ + 3e
5.1. Tác dụng với phi kim
a. Tác dụng với lưu huỳnh
b. Tác dụng với oxi
c. Tác dụng với clo
5.2. Tác dụng với axit
a. Tác dụng với dung dịch axit HCl, H2SO4 loãng
Fe + 2H+ → Fe2+ + H2
b. Với các axit HNO3, H2SO4 đặc
Fe + 4HNO3 l → Fe(NO3)3 + NO + 2H2O
Chú ý: Với HNO3 đặc, nguội; H2SO4 đặc, nguội: Fe bị thụ động hóa.
5.3. Tác dụng với dung dịch muối
Fe đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
Fe+ CuSO4 → FeSO4 + Cu
Chú ý:
Fe + 2Ag+ → Fe2+ + 2Ag
Ag+ dư + Fe2+ → Fe3+ + Ag
6. Bài tập vận dụng liên quan
Câu 1. Hệ số cân bằng của phương trình hóa học: Fe + HNO3 → Fe(NO3)3 + N2O + H2O
A. 8:24:8:3:12
B. 6:30:6:3:15
C. 6:30:6:2:15
D. 8:30:8:3:15
Lời giải:
Câu 2. Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính oxi hóa vừa tính khử khi tham gia phản ứng hóa học?
A. NH3, N2O5, N2, NO2
B. NH3, NO, HNO3, N2O5
C. N2, NO, NO2, N2O5
D. NO2, N2, NO, N2O3
Lời giải:
Nguyên tố N có các số oxi hóa: -3, 0, +1, + 2, +3, +4, +5
Những nguyên tố N mang số oxi hóa trung gian có khả năng vừa thể hiện tính oxi hóa, vừa thể hiện tính khử khi tham gia phản ứng
Trong NH3, Nitơ có số oxi hóa -3, là số oxi hóa thấp nhất nên chỉ thể hiện tính khử.
Trong HNO3 và N2O5, N có số oxi hóa +5, là số oxi hóa cao nhất nên chỉ thể hiện tính oxi hóa.
Câu 3. R có oxit cao nhất là R2O5, trong hợp chất của R với hiđro có 17,64% khối lượng H. Nguyên tố R là:
A. S
B. P
C. N
D. Cl
Lời giải:
R có oxit cao nhất là R2O5→ hợp chất của R với hiđro có dạng RH3
%H= 3M+3= 17,64100 → M= 14 → M là nguyên tố nitơ
Câu 4. Trong các oxit của nito thì oxit được điều chế trực tiếp từ phản ứng của nitơ với oxi là:
A. NO2
B. NO
C. N2O
D. N2O5
Lời giải:
Oxit được điều chế trực tiếp từ phản ứng của nitơ với oxi là NO.
N2 + O2 ⇔ 2NO.
Câu 5. Trong 3 oxit: FeO, Fe2O3, Fe3O4 thì chất nào phản ứng với HNO3 đặc nóng không tạo ra khí là:
A. Fe2O3
B. FeO và Fe3O4
C. Fe3O4
D. FeO
Lời giải:
Fe2O3 + 6HNO3→ 2Fe(NO3)3+ 3H2O
FeO + 4HNO3 đặc nóng → Fe(NO3)3 + NO2↑+ 2H2O
3Fe3O4 + 28HNO3 đặc nóng → 9Fe(NO3)3+ NO2↑+ 14H2O
Câu 6. Cho hỗn hợp gồm 0,14 mol Mg và 0,01 mol MgO phản ứng vừa đủ với dung dịch HNO3 thu được 0,448 lít (đktc) khí N2 và dung dịch X. Khối lượng muối trong X là:
A. 23 gam
B. 24,5 gam
C. 22,2 gam
D. 20,8 gam
Lời giải:
Bảo toàn nguyên tố Mg ta có : nMg(NO3)2= nMg+ nMgO = 0,15 mol
nkhí N2 = 0,02 mol.
Quá trình cho e:
Mg → Mg2++ 2e (1)
0,14 → 0,28 mol
Quá trình nhận e:
2NO3- + 10e + 12H+ → N2 + 6H2O (2)
0,2 ← 0,02 mol
Nểu chỉ có 1 quá trình nhận e (2) thì số mol e cho khác số mol e nhận
Do đó phải có quá trình nhận e (3) và số mol e nhận ở (3) bằng:
0,28 - 0,2=0,08 mol
NO3-+ 8e + 10H+ → NH4++ 3H2O (3)
0,08 → 0,01 mol
Muối trong X gồm 0,15 mol Mg(NO3)2 và 0,01 mol NH4NO3
→mmuối= 0,15.148+ 0,01.80 = 23 gam
Câu 7. Đốt cháy 5,6g bột Fe trong bình đựng O2 thu được 7,36g hỗn hợp X gồm 4 chất rắn. Hoà tan hỗn hợp X bằng dung dịch HNO3 vừa đủ thu được V ml (đktc) hỗn hợp khí Y gồm NO và NO2 (không còn sản phẩm khử nào khác của N+5) và dung dịch Z. Tỉ khối của Y so với H2 bằng 19. Giá trị của V là.
A. 0,336 lít
B. 0,224 lít
C. 0,896 lít
D. 1,008 lít
Lời giải:
MX = 19.2 = 38
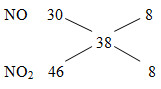
=> nN2 = nNO2 = x
mFe+ mO = moxit
=> mO = moxit- mFe = 7,36 - 5,6 = 1,76 gam
=> nO = 0,11 mol
Fe0 → Fe3+ + 3e
0,1 0,3
O0 +2e → O2-
N+5 + 3e → N+2
3x x x
N+5 +1e → N+4
0,11 0,22 x
Bảo toàn e: 0,3 = 0,22 + 3x + x =0,22 + 4x => x = 0,02
=> nkhí= 2x = 0,04 mol
=> Vkhí= 0,04.22,4 = 0,896 lít
Câu 8. Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe trong dung dịch HCl 4M thu được 11,2 lít H2 (đktc) và dung dịch D. Để kết tủa hoàn toàn các ion trong D cần 600 ml dung dịch NaOH 2M. Thể tích dung dịch HCl đã dùng là :
A. 0,1 lít.
B. 0,3 lít.
C. 0,15 lít.
D. 0,2 lít.
Lời giải:
nNaCl= nNaOH = 1,2 (mol)
Áp dụng định luật bảo toàn nguyên tố Clo
=> nHCl= nNaCl= 1,2 (mol)
VHCl = 1,24 = 0,3 lít
Câu 9. Đều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch
A. một lượng sắt dư .
B. một lượng kẽm dư.
C. một lượng HCl dư.
D. một lượng HNO3 dư.
Lời giải:
Dung dịch FeCl2 dễ bị không khí oxi hóa thành muối Fe3+ . Để bảo quản FeCl2 người ta thêm 1 lương Fe vì: Fe + 2Fe3+ → 3Fe2+
Không dùng HNO3 vì HNO3 oxi hóa luôn ion Fe2+ thành Fe3+,
Không dùng Zn sẽ tạo ra 1 lượng muối Zn2+,
Không dùng HCl sẽ không ngăn cản quá trình tạo Fe3+.
Câu 10. Cho hỗn hợp X gồm FexOy, Fe, MgO, Mg. Cho m gam hỗn hợp X trên tác dụng với dung dịch HNO3 dư thu được 6,72 lít hỗn hợp khí N2O và NO (đktc) có tỉ khối hơi so với H2 là 15,933 và dung dịch Y. Cô cạn dung dịch Y thu được 129,4 gam muối khan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng dư thu được 15,68 lít khí SO2 (đktc, sản phẩm khử duy nhất của S+6) và dung dịch Z. Cô cạn dung dịch Z thu được 104 gam muối khan. Giá trị gần nhất của m là
A. 29,0.
B. 28,5.
C. 27,5.
D. 22,0.
Lời giải:
Đặt nO = z mol
TN1: ne (1) = 2z + 8nN2O + 3nNO + 8nNH4+ => ne (1) = 2z + 8.0,04 + 3.0,26 + 8nNH4+
TN2: ne (2) = 2z + 2nSO2 => ne (2) = 2z + 2.0,7
Mà ne(1) = ne(2) => nNH4+ = 0,0375 (mol)
TN1: nNO3-(muối KL) = ne = 2z + 1,4 (mol)
m muối (1) = mKL + mNO3-(muối KL) + mNH4NO3 => mKL + 62(2z + 1,4) + 80.0,0375 = 129,4 (1)
TN2: mSO42- = ne/2 = z + 0,7
m muối (2) = mKL + mSO42- => mKL + 96(z + 0,7) = 104 (2)
Từ (1) và (2) => mKL = 27,2 gam và z = 0,1 mol
=> m = mKL + mO = 27,2 + 0,1. 16 = 28,8 gam
Xem thêm các phương trình hóa học liên quan đến Fe khác:
Fe + HNO3 → Fe(NO3)3 + NO + H2O | Fe ra Fe(NO3)3
Fe + HNO3 → Fe(NO3)3 + NO2 + H2O | Fe ra Fe(NO3)3
Fe + H2SO4 → FeSO4 + H2 | Fe ra FeSO4