Công thức pH của dung dịch hay nhất
1. Lí thuyết
1.1 Công thức tính pH
- Nồng độ H+ được dùng để đánh giá độ axit và độ kiềm của dung dịch. Tuy nhiên dung dịch thường dùng có nồng độ H+ nhỏ. Để tránh ghi nồng độ H+ với số mũ âm, người ta dùng giá trị pH với quy ước như sau :
[H+] = 10-pH M . Nếu [H+] =10-aM => pH= a
- Về mặt toán học
[H+] = 10-pH M=> pH = -lg[H+]
1.2 Kiến thức mở rộng
- Độ axit và độ kiềm của dung dịch được đánh giá chỉ bằng nồng độ :
+ Môi trường trung tính: [ H+] = 1,0.10-7 M
+ Môi trường axit: [ H+] > 1,0.10-7 M
+ Môi trường kiềm: [ H+] < 1,0.10-7 M
- Độ axit và độ kiềm của dung dịch được đánh giá qua pH:
+ Môi trường trung tính: pH= 7
+ Môi trường axit: pH < 7
+ Môi trường kiềm: pH > 7
- Thang pH thường dùng có giá trị từ 1 đến 14.
- Giá trị của pH có ý nghĩa to lớn trong thực tế:
+ Giá trị pH trong dịch dạ dày khoảng 1,0-2,0.
+ Giá trị pH trong máu khoảng 7,30-7,45.
+ Giá trị pH trong nước để ngoài không khí là 5,5.
- Trong dung dịch ta luôn có tích số ion của nước không đổi:
[ H+]. [OH-] = 10-14
=> [OH-] = 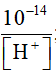 ; [H-] =
; [H-] = 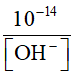
- Công tính pH theo [OH-]
pH = 14 + lg[OH-]
2. Bài tập vận dụng
Bài 1: Tính pH của dung dịch HCl 0,001M?
A. 1
B. 2
C. 3
D. 4
Hướng dẫn
Phương trình điện li: HCL -> H+ + Cl-
=> [H+] = [ HCl] = 0,001M = 10-3M
=> pH= 3
Đáp án C
Bài 2: pH của dung dịch NaOH 0,001M là
A. 3
B. 4
C. 11
D. 10
Hướng dẫn
Phương trình điện li: NaOH -> Na+ + OH-
=> [OH-] =[NaOH] = 0,001M = 10-3M
=> [H+] = 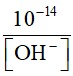 = 10-11M
= 10-11M
=> pH= 11
Đáp án C
Bài 3: Tính pH của 500ml dung dịch H2SO4, biết rằng để trung hòa lượng axit trên cần vừa đủ 0,005 mol NaOH?
A. 1
B. 2
C. 3
D. 4
Hướng dẫn
Phương trình:
H2SO4 -> 2H+ + SO42-
NaOH -> Na+ + OH-
H+ + OH- -> H2O
Ta có: nOH- = nNaOH = 0,005 mol => nH+= nOH- = 0,005 mol
=> [H+] = 0,01M = 10-2 M
=> pH = 2
Đáp án B
Bài 4: Dung dịch Ba(OH)2 0,01M có pH bằng
A. pH = 12,3
B. pH = 10
C. pH = 7
D. pH = 11
Hướng dẫn
Ba(OH)2 -> Ba2+ + 2OH-
=> [OH-] = 2[Ba(OH)2] =0,02 M
=> pH= 14+ lg[OH-] =12,3
Đáp án A
Bài 5: Cho các muối sau đây: NaNO3; K2CO3; CuSO4; FeCl3; AlCl3; KCl. Các dung dịch có pH = 7 là :
A. NaNO3; KCl.
B. K2CO3; CuSO4; KCl.
C. CuSO4; FeCl3; AlCl3.
D. NaNO3; K2CO3; CuSO4.
Đáp án: A
K2CO3: Bazơ
CuSO4, FeCl3, FeCl2: Axit
Bài 6: Chọn câu trả lời đúng, khi nói về muối axit :
A. Dung dịch muối có pH < 7.
B. Muối cố khả năng phản ứng với bazơ.
C. Muối vẫn còn hiđro trong phân tử.
D. Muối mà gốc axit vẫn còn hiđro có khả năng phân li tạo proton trong nước.
Đáp án: D
Bài 7: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là
A. 10 ml. B. 15 ml. C. 20 ml. D. 25 ml.
Đáp án: C
H+ + OH- → H2O
Ta có: ⇒ V = 20 ml.
Bài 8: Dung dịch A có chứa 5 ion :Mg2+ ,Ba2+ ,Ca2+ và 0,1 mol Cl- và 0,2 mol NO3 . Thêm dần V ml dung dịch K2CO3 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là
A. 150 ml. B. 300 ml. C. 200 ml. D. 250 ml.
Đáp án: A
Khi thêm K2CO3 vào dung dịch A, khi lượng kết tủa thu được là lớn nhất tức là toàn bộ Mg2+, Ba2+, Ca2+ đã kết tủa, trong dung dịch còn lại KCl và KNO3
⇒ nK+ = nCl- + nNO3- = 0,3 mol
⇒ nK2CO3 = 0,15 mol
⇒ VK2CO3 = 150 ml
Bài 9: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch
Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A. 0,15 và 2,330 B. 0,10 và 6,990.
C.0,10 và 4,660 D. 0.05 và 3,495
Đáp án: D
Sau phản ứng trung hòa pH = 1 ⇒ H+ dư
H+ + OH- → H2O
nH+bd = 0,08 mol; sau phản ứng pH = 1
⇒ nH+ sau p/ư = 0,05 mol
nH+p/ư = nOH- = 0,03 mol
⇒ nBa(OH)2 = 0,015 mol
⇒ CM Ba(HCO3)2 = 0,05 (mol/l)
nBaSO4 = nBa(OH)2 = 0,015 mol (H2SO4 dư) ⇒ mBaSO4 = 3,495g
Bài 10: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là
A. 134. B. 147. C. 114. D. 169.
Đáp án: A
Coi 300 ml dung dịch A gồm 100 ml H2SO4 0,1M 100 ml HNO3 0,2M và 100 ml HCl 0,3M trộn lại với nhau. Vậy:
Phản ứng của dung dịch A và B là: H+ + OH- → H2O
nH+ p/ư = nOH- = 0,049.0,001V ⇒ nH+ p/ư = 0,01 (0,3 + 0,001V)
⇒ 0,07 = 0,49.0,001V + 0,010,3 + 0,001V) ⇒ V = 134 ml
Xem thêm các bài tập Hóa Học hay khác:
Công thức tính đồng phân amin (2024) chi tiết, đầy đủ nhất
Công thức tính đồng phân anken (2024) chi tiết, chính xác nhất
Công thức tính đồng phân ankan 92024) đầy đủ, chi tiết nhất
Công thức tính độ tan (2024) chi tiết, chính xác nhất
30 Bài tập CO2 tác dụng với dung dịch kiềm (2024) có đáp án chi tiết nhất