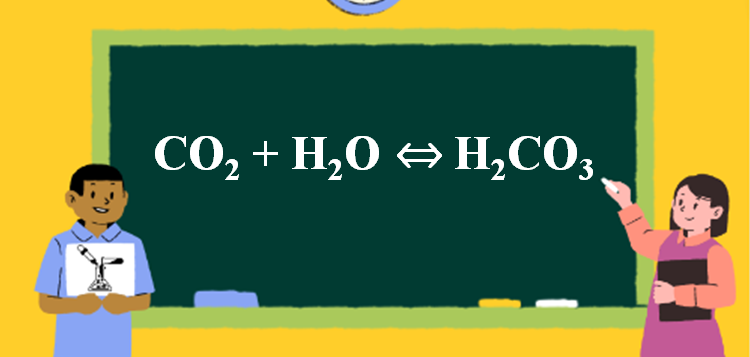Phản ứng CO2 + H2O → H2CO3
1. Phương trình phản ứng CO2 tác dụng H2O
CO2 + H2O ⇔ H2CO3
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Bản chất của các chất tham gia phản ứng
- CO2 (Cacbon đioxit) là một oxit axit khi tan trong nước tạo thành H2CO3.
- H2CO3 (Axit cacbonic) là axit kém bền do đó dễ dàng phân hủy tạo ra CO2, H2O.
4. Mở rộng kiến thức về CO2
4.1. Tính chất vật lý
- Là chất khí không màu, nặng gấp 1,5 lần không khí.
- Tan ít trong nước.
- CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
4.2. Tính chất hóa học
Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
a. CO2 là oxit axit
- CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇔ H2CO3 (dd)
- CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 → CaCO3 (tº)
- CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
b. CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇔ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C (Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
c. CO2 còn được dùng để sản xuất ure
CO2 + 2NH3 → NH4O - CO - NH2 (amoni cacbamat)
NH4O - CO - NH2 → H2O + (NH2)2CO (180ºC; 200at)
4.3. Điều chế
- Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
- Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
- Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2 H2O
- Trong công nghiệp:
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
- Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
5. Tính chất hóa học của H2O
5.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số kim loại trung bình như Mg, Zn, Al, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và hidro. Bên cạnh đó, kim loại Mg tan rất chậm trong nước nóng.
5.2. Nước tác dụng với oxit bazo
Nước tác dụng với một số oxit bazo như Na2O, CaO , K2O,… tạo thành dung dịch bazo tương ứng. Dung dịch bazo làm cho quỳ tím hóa xanh.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
5.3. Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
6. Bài tập vận dụng
Câu 1. Dãy chất nào sau đây tan trong nước
A. CO2, SO2, CaO
B. BaO, CuO, N2O5
C. CaO, FeO, CO2
D. N2O5, CaO, ZnO
Lời giải:
Đáp án: A
Câu 2. Dãy chất nào sau đây hòa tan vào nước cho dung dịch làm quỳ tím hóa đỏ?
A. N2O5, CaO, CO2
B. SO3, N2O5, P2O5
C. CO2, Na2O, N2O5
D. CO, CO2, N2O5
Lời giải:
Đáp án: B
Câu 3. Khi nhiệt phân, nhóm các muối nitrat cho sản phẩm kim loại, khí NO2, O2 là
A. Cu(NO3)2, Pb(NO3)2.
B. Ca(NO3)2, Hg(NO3)2, AgNO3.
C. Zn(NO3)2, AgNO3, LiNO3.
D. Hg(NO3)2, AgNO3.
Lời giải:
Đáp án: D
Câu 4. Chất nào sau đây được dùng làm bột nở trong công nghiệp thực phẩm?
A. KOH
B. NaOH
C. Na2CO3
D. NaHCO3
Lời giải:
Đáp án: D
Câu 5. “Nước đá khô” không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là
A. CO rắn.
B. SO2 rắn.
C. H2O rắn.
D. CO2 rắn.
Lời giải:
Đáp án: D
Nước đá khô là CO2 rắn.
Câu 6. Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 1M thu được 6g kết tủa. Lọc kết tủa đun nóng dung dịch lại thấy có kết tủa nữa. Giá trị của V là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 3,136 lít.
Lời giải:
Đáp án: D
Do đun nóng dung dịch lại thu được kết tủa → Sau phản ứng thu được 2 muối
CaCO3 0,06 mol và Ca(HCO3)2 x mol
Bảo toàn nguyên tố Ca có: 0,1 = x + 0,06 → x = 0,04 mol
Bảo toàn nguyên tố C có nkhí = 2.0,04 + 0,06 = 0,14 mol
V = 0,14.22,4 = 3,136 lít.
Câu 7. Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, nồng độ mol của chất tan trong dung dịch X là
A. 0,1M.
B. 0,4M.
C. 0,6M.
D. 0,2M.
Lời giải:
Đáp án: D
nkhí = 0,15 mol; nOH- = 0,125.2 = 0,25 mol
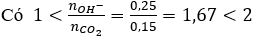
Bảo toàn nguyên tố Ba: x + y = 0,125
Bảo toàn nguyên tố C: x + 2y = 0,15
Giải hệ → x = 0,1 và y = 0,025 mol
Chất tan trong X là Ba(HCO3)2, CM = 0,025 : 0,125 = 0,2M.
Xem thêm các phương trình hóa học khác:
KOH + CO2 → KHCO3 l KOH ra KHCO3
CaO + CO2 → CaCO3 | CaO ra CaCO3