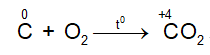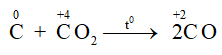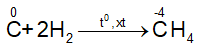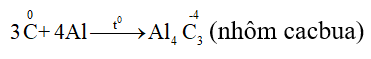Phản ứng C + CO2 → CO
1. Phản ứng tạo thành khí CO
C + CO2 2CO
2. Điều kiện phản ứng C ra CO
Nhiệt độ cao trong lò.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của C (Cacbon)
- Trong phản ứng trên C là chất khử.
- C chủ yếu thể hiện tính khử khi tác dụng với CO2, O2,...
3.2. Bản chất của CO2 (Cacbon dioxit)
- Trong phản ứng trên CO2 là chất oxi hoá.
- CO2 là oxit axit bền, ở nhiệt độ cao thể hiện tính oxi hóa khi tác dụng với các chất khử mạnh.
4. Tính chất hóa học của C
- Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
- Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
4.1. Tính khử
- Tác dụng với oxi
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
4.2. Tính oxi hóa
- Tác dụng với hidro
- Tác dụng với kim loại
5. Bài tập vận dụng
Câu 1: Thành phần chính của quặng hemantit là:
A. Fe3O4
B. Fe2O3
C. FeO
D. Fe
Lời giải:
Đáp án: B
Câu 2: Trong công nghiệp đời sống, gang và thép được sử dụng nhiều vì có ưu điểm là
A. Cứng, dẻo, ít bị ăn mòn
B. Cứng, đàn hồi và nhẹ
C. Mềm, dễ nóng chảy và nhẹ
D. Dễ nóng chảy, nhẹ và ít bị ăn mòn
Lời giải:
Đáp án: A
Câu 3: Phát biểu nào sau đây đúng?
A. Thép là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon nhỏ hơn 2%
B. Thép là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2% - 5%
C. Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon nhỏ hơn 2%
D. Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon lớn hơn 2%
Lời giải:
Đáp án: C
Câu 4. Trong quá trình sản xuất gang, thép, khí nào bị thải ra gây ảnh hưởng đến môi trường?
A. SO2
B. H2
C. N2O
D. O2
Lời giải:
Đáp án: A
Câu 5. Thổi khí CO vào lò luyện thép phản ứng hóa học không xảy ra là:
A. O2 + Fe → 2FeO
B. C + O2 → CO2
C. FeO + CO→ Fe + CO2
D. 2FeO + 2Mn → Fe + MnO2
Lời giải:
Đáp án: A
Xem thêm các phương trình hóa học liên quan khác:
C + H2SO4 → SO2 + CO2 + H2O | C ra SO2
Fe3O4 + CO → FeO + CO2 | Fe3O4 ra FeO
CaO + CO2 → CaCO3 | CaO ra CaCO3
SiO2 + Na2CO3 → Na2SiO3 + CO2 | Na2CO3 ra Na2SiO3
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3 | C6H5ONa ra C6H5OH | C6H5ONa ra phenol