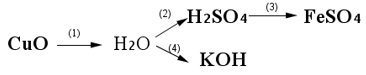
Câu hỏi:
10/04/2024 33
Tổng hệ số tối giản của phương trình: Al + Cl2 AlCl3 là:
A. 5.
B. 6.
C. 7.
D. 8.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án C
Phương pháp giải:
Có thể cân bằng phương trình hóa học theo 1 trong những phương pháp sau:
Phương pháp kim loại – phi kim
Phương pháp chẵn – lẻ
Phương pháp nguyên tử nguyên tố
Phương pháp dùng hệ số phân số
Phương pháp hóa trị
=> sau đó cộng tổng hệ số các chất của phương trình lại.
Giải chi tiết:
2Al + 3Cl2 2AlCl3
=> tổng hệ số = 2+ 3 + 2 = 7
Đáp án C
Phương pháp giải:
Có thể cân bằng phương trình hóa học theo 1 trong những phương pháp sau:
Phương pháp kim loại – phi kim
Phương pháp chẵn – lẻ
Phương pháp nguyên tử nguyên tố
Phương pháp dùng hệ số phân số
Phương pháp hóa trị
=> sau đó cộng tổng hệ số các chất của phương trình lại.
Giải chi tiết:
2Al + 3Cl2 2AlCl3
=> tổng hệ số = 2+ 3 + 2 = 7
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Đốt cháy hoàn toàn 13,4 gam hỗn hợp X gồm: Fe, Al và Cu trong 2,24 lít khí O2 (đktc), sau phản ứng thu được m gam chất rắn. Giá trị của m là: (biết oxi phản ứng hết)
Đốt cháy hoàn toàn 13,4 gam hỗn hợp X gồm: Fe, Al và Cu trong 2,24 lít khí O2 (đktc), sau phản ứng thu được m gam chất rắn. Giá trị của m là: (biết oxi phản ứng hết)
Câu 2:
Cân bằng các phương trình phản ứng hoá học sau: Zn + HCl → ZnCl2 + H2.
Cân bằng các phương trình phản ứng hoá học sau: Zn + HCl → ZnCl2 + H2.
Câu 3:
Cân bằng các phương trình phản ứng hoá học sau: Fe2O3 + HCl → FeCl3 + H2O.
Cân bằng các phương trình phản ứng hoá học sau: Fe2O3 + HCl → FeCl3 + H2O.
Câu 5:
Cân bằng các phương trình phản ứng hoá học sau: MgCl2 + NaOH → Mg(OH)2 + NaCl.
Câu 6:
Hoà tan hoàn toàn 5,6 gam Fe trong dung dịch HCl, sau phản ứng thu được FeCl2 và khí H2.
a. Tính khối lượng FeCl2 thu được sau phản ứng.
b. Tính số mol HCl đã tham gia phản ứng.
Hoà tan hoàn toàn 5,6 gam Fe trong dung dịch HCl, sau phản ứng thu được FeCl2 và khí H2.
a. Tính khối lượng FeCl2 thu được sau phản ứng.
b. Tính số mol HCl đã tham gia phản ứng.