Câu hỏi:
05/01/2024 173
Nguyên tử nitrogen chỉ thể hiện tính oxi hoá (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
A. N2.
B. NH3.
C. NO.
D. NaNO3.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án: D
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Để điều chế khí chlorine (Cl2) trong phòng thí nghiệm, người ta thường cho potassium permanganate (KMnO4) tác dụng với hydrogen chloride (HCl):
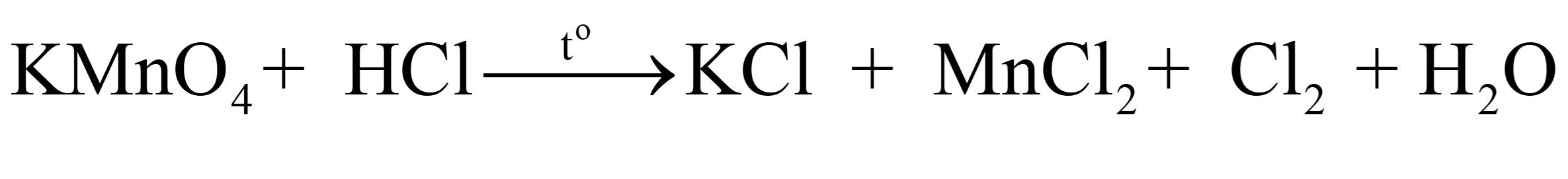
a) Lập phương trình hóa học của phản ứng hóa học trên bằng phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Giả sử lượng khí chlorine sinh ra phản ứng vừa đủ với dung dịch chứa 9,96 muối KX (X là một nguyên tố halogen) thu được 4,47 gam một muối duy nhất. Xác định công thức phân tử của muối KX.
Để điều chế khí chlorine (Cl2) trong phòng thí nghiệm, người ta thường cho potassium permanganate (KMnO4) tác dụng với hydrogen chloride (HCl):
![]()
a) Lập phương trình hóa học của phản ứng hóa học trên bằng phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Giả sử lượng khí chlorine sinh ra phản ứng vừa đủ với dung dịch chứa 9,96 muối KX (X là một nguyên tố halogen) thu được 4,47 gam một muối duy nhất. Xác định công thức phân tử của muối KX.
Câu 2:
Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g) \[{\Delta _r}H_{298}^0{\rm{ }} = --92{\rm{ }}kJ.\]
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g) \[{\Delta _r}H_{298}^0{\rm{ }} = --92{\rm{ }}kJ.\]
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
Câu 3:
Yếu tố nào được sử dụng để tăng tốc độ phản ứng trong trường hợp sau: “Sự cháy diễn ra mạnh và nhanh hơn khi đưa lưu huỳnh (sulfur) đang cháy ngoài không khí vào lọ đựng khí oxygen”?
Câu 4:
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
Câu 5:
Cho 2,9825 gam hỗn hợp A gồm: NaX, NaY (X, Y là hai halogen liên tiếp, nguyên tử khối của X nhỏ hơn của Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 0,7175 gam kết tủa. Xác định hai nguyên tố X, Y.
Câu 6:
Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có \({\Delta _f}H_{298}^o\) tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có \({\Delta _f}H_{298}^o\) tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
Câu 7:
Cho các hợp chất sau: N2, N2O, NH3, HNO3, (NH4)2CO3. Số trường hợp trong đó nitrogen có số oxi hoá -3 là
Câu 9:
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
\[CO(g) + \frac{1}{2}{O_2}(g) \to C{O_2}(g)\,\,\,\,\,\,\,{\Delta _r}H_{298}^0 = - 283,00kJ\]
Giá trị \[{\Delta _r}H_{298}^0\] của phản ứng 2CO(g) + O2(g) → 2CO2(g) là
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
\[CO(g) + \frac{1}{2}{O_2}(g) \to C{O_2}(g)\,\,\,\,\,\,\,{\Delta _r}H_{298}^0 = - 283,00kJ\]
Giá trị \[{\Delta _r}H_{298}^0\] của phản ứng 2CO(g) + O2(g) → 2CO2(g) là
Câu 11:
Rót 3 mL dung dịch HCl 1 M vào 2 mL dung dịch NaOH 1 M, cho quỳ tím vào dung dịch sau phản ứng, mẩu quỳ tím sẽ:
Câu 12:
Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính khử.
(b) Hydrofluoric acid là acid yếu.
(c) Trong hợp chất, các halogen đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–.
Trong các phát biểu trên, số phát biểu sai là
Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính khử.
(b) Hydrofluoric acid là acid yếu.
(c) Trong hợp chất, các halogen đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–.
Trong các phát biểu trên, số phát biểu sai là
Câu 15:
Cho phương trình nhiệt hóa học của phản ứng:
 \[{\Delta _r}H_{298}^o = + 131,25kJ\]
\[{\Delta _r}H_{298}^o = + 131,25kJ\]
Phản ứng trên là phản ứng
Cho phương trình nhiệt hóa học của phản ứng:
![]() \[{\Delta _r}H_{298}^o = + 131,25kJ\]
\[{\Delta _r}H_{298}^o = + 131,25kJ\]
Phản ứng trên là phản ứng


