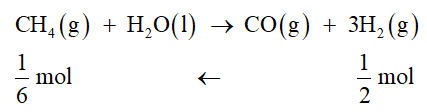Cho phản ứng: CH4(g) + H2O(l) → CO(g) + 3H2(g) ∆r Ho298 = 249,9 kJ Ở điều kiện chuẩn
Luyện tập 1 trang 83 Hóa học 10: Cho phản ứng:
CH4(g) + H2O(l) → CO(g) + 3H2(g) ∆r Ho298 = 249,9 kJ
Ở điều kiện chuẩn, để thu được 1 gam H2, phản ứng này cần hấp thu nhiệt lượng bằng bao nhiêu?