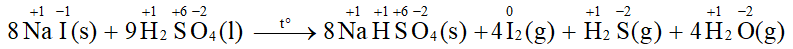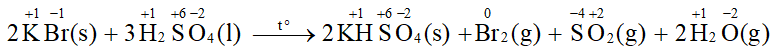Giải Hóa học 10 Bài 18: Hydrogen halide và hydrohalic acid
Lời giải:
Tính acid của các dung dịch HX tăng theo dãy từ HF đến HI. Trong đó, hydrofluoric acid là acid yếu do chỉ phân li một phần trong nước. Còn hydrochloric acid, hydrobromic acid và hydroiodic acid được xếp vào loại acid mạnh do phân li hoàn toàn trong nước.
Ví dụ: HCl(aq) → H+(aq) + Cl-(aq)
Nguyên nhân chủ yếu làm tăng độ mạnh của các acid theo dãy trên là do sự giảm độ bền liên kết theo thứ tự: HF, HCl, HBr, HI (acid nào càng dễ dàng phân li ra ion H+ trong nước thì tính acid càng mạnh)
I. Hydrogen halide và hydrohalic acid
Lời giải:
HX là hợp chất cộng hóa trị phân cực do sự chênh lệch độ âm điện giữa nguyên tử hydrogen với các nguyên tử halogen. Mà độ âm điện giảm dần từ F đến I.
⇒ Xu hướng phân cực của các phân tử HX giảm dần từ HF đến HI.
Lời giải:
Nhiệt độ mà ở đó một chất lỏng bắt đầu sôi để chuyển sang thể khí (xảy ra cả trên bề mặt và trong lòng chất lỏng) gọi là nhiệt độ sôi.
Khi các chất ở thể khí, nhiệt độ được hạ xuống thấp dần thì hydrogen fluoride (HF) sẽ hóa lỏng trước, tiếp đến lần lượt là hydrogen iodide (HI), hydrogen bromide (HBr) và cuối cùng khí được hóa lỏng ở nhiệt độ thấp nhất là hydrogen chloride (HCl).
II. Tính khử của một số ion halide X-
Lời giải:
Phản ứng của sodium chloride rắn với sulfuric acid đặc không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của nguyên tố nào trước và sau phản ứng.
Phản ứng của sodium iodide rắn với sulfuric acid đặc là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của I (từ -1 lên 0) và S (từ +6 về -2)
Lời giải:
Không thể điều chế được hydrogen bromide (HBr(g)) từ phản ứng giữa potassium bromide (KBr) với sulfuric acid đặc, đun nóng. Vì ion Br- thể hiện tính khử và khử sulfur trong H2SO4
III. Ứng dụng của một số hydrogen halide
Vận dụng trang 112 Hóa học 10: Vật dụng bằng kim loại đồng dễ bị phủ bởi lớp copper(II) oxide.
a) Vì sao có thể sử dụng dung dịch hydrochloric acid để tẩy rửa copper(II) oxide?
b) Có thể sử dụng một số dung dịch thường có sẵn trong gia đình để tẩy rửa copper(II) oxide. Đó có thể là dung dịch nào? Vì sao?
Lời giải:
a) Có thể sử dụng dung dịch hydrochloric acid để tẩy rửa copper(II) oxide vì xảy ra phản ứng:
CuO(s) + 2HCl(aq) → CuCl2(aq) + H2O(l)
b) Ngoài ra có thể sử dụng một số dung dịch thường có sẵn trong gia đình để tẩy rửa copper(II) oxide như: dung dịch giấm ăn, nước chanh … vì các dung dịch này cũng có chứa acid.
IV. Phân biệt các ion halide X-
Thực hành trang 113 Hóa học 10: Nhận biết các dung dịch.
Có bốn bình nhỏ được đậy bằng nút có ống nhỏ giọt. Mỗi bình chứa một trong các dung dịch sodium chloride, sodium bromide, sodium iodide, hydrochlodric acid nhưng tên hóa chất ghi trên nhãn đã bị nhòe.
Hãy thảo luận về hóa chất, dụng cụ cần dùng và trình tự tiến hành thí nghiệm để nhận ra mỗi bình chứa dung dịch gì. Tiến hành thí nghiệm, ghi lại kết quả. Lặp lại thí nghiệm để kiểm tra kết quả.
Lời giải:
Thuốc thử: Dung dịch silver nitrate (AgNO3)
Dụng cụ: 4 ống nghiệm, nhãn, 4 mẩu giấy quỳ tím.
Cách tiến hành:
- Trích mẫu thử của từng dung dịch ra ống nghiệm và đánh số thứ tự.
- Nhỏ vài giọt từng mẫu thử vào từng mẩu giấy quỳ tím.
- Nhỏ vài giọt dung dịch silver nitrate (AgNO3) vào từng ống nghiệm.
Kết quả:
- Nhỏ vài giọt từng mẫu thử vào từng mẩu giấy quỳ tím.
+ Mẫu thử làm quỳ tím hóa đỏ là hydrochlodric acid (HCl).
+ Không có hiện tượng gì là các dung dịch còn lại.
- Nhỏ vài giọt dung dịch silver nitrate (AgNO3) vào từng ống nghiệm.
+ Ống nghiệm xuất hiện kết tủa màu trắng thì mẫu đem thử là sodium chloride (NaCl)
NaCl(aq) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
+ Ống nghiệm xuất hiện kết tủa màu vàng nhạt thì mẫu đem thử là sodium bromide (NaBr)
NaBr(aq) + AgNO3(aq) → NaNO3(aq) + AgBr(s)
+ Ống nghiệm xuất hiện kết tủa màu vàng đậm thì mẫu đem thử là sodium iodide (NaI)
NaI(aq) + AgNO3(aq) → NaNO3(aq) + AgI(s)
Lời giải:
- Nhỏ dung dịch silver nitrate (AgNO3) vào ống nghiệm chứa dung dịch potassium fluoride (KF).
+ Hiện tượng: Không thấy sự thay đổi
+ Phương trình hóa học:
KF(aq) + AgNO3(aq) Không xảy ra phản ứng.
- Nhỏ dung dịch silver nitrate (AgNO3) vào ống nghiệm chứa dung dịch hydrochloric acid (HCl)
+ Hiện tượng: Xuất hiện chất không tan màu trắng.
+ Phương trình hóa học: HCl(aq) + AgNO3(aq) → AgCl(s)↓ (màu trắng) + HNO3(aq)
- Nhỏ dung dịch silver nitrate (AgNO3) vào ống nghiệm chứa dung dịch sodium bromide (NaBr)
+ Hiện tượng: Xuất hiện chất không tan màu vàng nhạt
NaBr(aq) + AgNO3(aq) → AgBr(s)↓ (màu vàng nhạt) + NaNO3(aq)
Bài tập (trang 114)
Lời giải:
Nhiệt độ sôi của hydrogen bromide (HBr) cao hơn nhiệt độ sôi của hydrogen chloride (HCl) được giải thích bằng hai nguyên nhân:
- Thứ nhất, khối lượng phân tử của HBr cao hơn khối lượng phân tử HCl nên năng lượng cần thiết cho quá trình sôi của HBr cao hơn.
- Thứ hai, kích thước và số lượng electron trong phân tử HBr lớn hơn làm tăng cường thêm khả năng xuất hiện các lưỡng cực tạm thời trong phân tử. Khi đó làm tăng tương tác van der Waals giữa các phân tử HBr.
Lời giải:
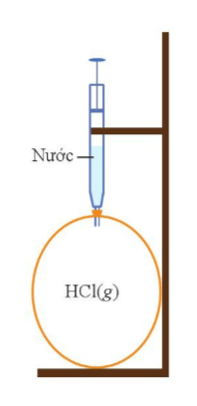
Hydrogen chloride ở thể khí chiếm toàn bộ thể tích quả bóng. Khi bơm nước vào xi-xanh, hydrogen chloride tan trong nước tạo dung dịch hydrochloric acid khiến thể tích giảm
⇒ Quả bóng bị xẹp đi
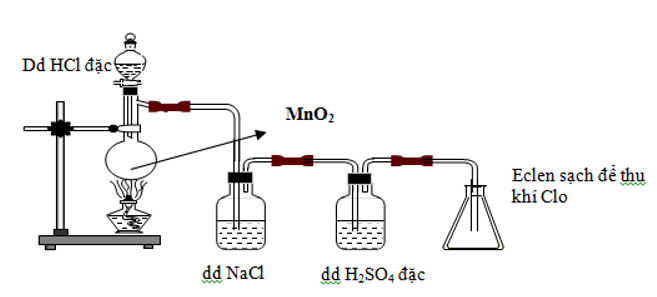
4HCl + MnO2 Cl2 + MnCl2 + 2H2O
Cho biết khí chlorine thu được có thể lẫn với chất nào. Chỉ ra chất khử và chất oxi hóa trong phản ứng trên.
b) Hãy dự đoán, hydroiodic acid có phản ứng được với manganese(IV) oxide không. Giải thích.
Lời giải:
a) Khí chlorine có thể bị lẫn khí HCl và hơi nước. Dẫn khí tạo thành qua bình đựng dung dịch NaCl để giữ lại HCl. Dẫn khí qua bình đựng dung dịch H2SO4 đặc để giữ hơi nước. Khí chlorine thu được cuối cùng là tinh khiết.
Chất khử: HCl (số oxi hóa của Cl tăng từ -1 lên 0)
Chất oxi hóa: MnO2 (số oxi hóa của Mn giảm từ +4 xuống +2)
b) Hydroiodic acid (HI) có phản ứng được với mangan(IV) oxide (MnO2). Vì tính khử của I- lớn hơn Cl-
Chất khử: HI (số oxi hóa của I tăng từ -1 lên 0)
Chất oxi hóa: MnO2 (số oxi hóa của Mn giảm từ +4 xuống +2)
a) Từ hiện tượng được mô tả trên, hãy dự đoán sản phẩm của quá trình dung dịch hydrobromic acid bị oxi hóa bởi oxygen trong không khí.
b) Thực tế, hydrobromic acid được bảo quản trong các lọ kín tối màu. Giải thích.
Lời giải:
a) Dự đoán sản phẩm gồm: Br2 (màu vàng nâu) và H2O
Phương trình hóa học của phản ứng: 4HBr + O2 → 2Br2 + 2H2O
b) Thực tế, hydrobromic acid dễ bị phân hủy khi có ánh sáng nên thường được bảo quản trong các lọ kín tối màu.
Xem thêm lời giải bài tập SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 13: Phản ứng oxi hóa – khử
Bài 14: Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học