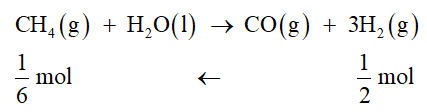Giải Hóa học 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Mở đầu trang 82 Hóa học 10: Cho hai phản ứng đốt cháy:
(1) C(s) + O2(g) → CO2(g) ∆r = -393,5 kJ
(2) 2Al(s) + O2(g) → Al2O3(s) ∆ r = -1675,7 kJ
Với cùng một khối lượng C và Al, chất nào khi đốt cháy tỏa ra nhiều nhiệt hơn?
Lời giải:
Giả sử đốt cháy hoàn toàn 1 gam C và 1 gam Al ta có:
Đốt cháy hoàn toàn 1 mol C tỏa ra 393,5 kJ nhiệt lượng
Nếu đốt cháy hoàn toàn mol C tỏa ra 393,5. = 32,79 kJ nhiệt lượng
Đốt cháy hoàn toàn 2 mol Al tỏa ra 1675,7 kJ nhiệt lượng
Nếu đốt cháy hoàn toàn mol Al tỏa ra . = 31,03 kJ nhiệt lượng
Vậy với cùng một khối lượng C và Al, khi đốt cháy C tỏa ra nhiều nhiệt hơn.
I. Ý nghĩa về dấu và giá trị của biến thiên enthalpy phản ứng
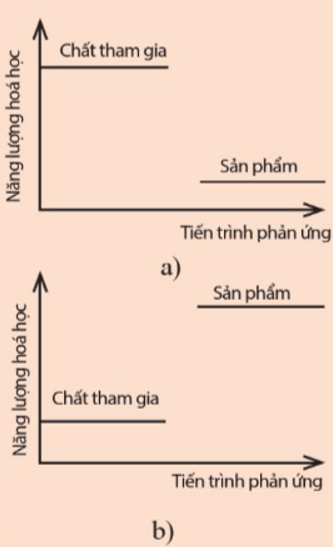
Lời giải:
Hình a) năng lượng của hệ chất tham gia cao hơn năng lượng của hệ sản phẩm ⇒ Phản ứng diễn ra kèm theo sự giải phóng năng lượng dưới dạng nhiệt ⇒ Phản ứng tỏa nhiệt.
Hình b) năng lượng của hệ chất tham gia thấp hơn năng lượng của hệ sản phẩm ⇒ Phản ứng diễn ra kèm theo sự hấp thu năng lượng dưới dạng nhiệt ⇒ Phản ứng thu nhiệt.
Luyện tập 1 trang 83 Hóa học 10: Cho phản ứng:
CH4(g) + H2O(l) → CO(g) + 3H2(g) ∆r = 249,9 kJ
Ở điều kiện chuẩn, để thu được 1 gam H2, phản ứng này cần hấp thu nhiệt lượng bằng bao nhiêu?
Lời giải:
Để đốt cháy 1 mol CH4(g) cần hấp thu 249,9 kJ nhiệt lượng
Vậy đốt cháy mol CH4(g) cần hấp thu 249,9. = 41,65 kJ nhiệt lượng.
Lời giải:
Nước mắm là hỗn hợp của muối với các acid amin được chuyển biến từ protein trong thịt cá qua một quá trình thủy phân với tác nhân là các hệ enzim có sẵn trong ruột cá cùng với một loại vi khuẩn kị khí chịu mặn, nhờ các men chất đạm từ cá được cắt nhỏ thành các acid amin giúp cơ thể hấp thu trực tiếp và dễ dàng. Trong nước mắm cốt có chứa rất nhiều đạm giúp cung cấp năng lượng, giữ ấm cơ thể.
Thực tế chứng minh trước khi lặn xuống nước uống nước mắm cốt giúp cơ thể người lặn nóng lên, xuống nước không còn thấy giá rét, tránh được nguy cơ cảm lạnh. Nước mắm cốt giúp tăng sức, giữ ấm cơ thể khi lặn xuống mực nước sâu.
Lời giải:
Khi đốt cháy tờ giấy hay đốt lò than, ta cần thực hiện giai đoạn khơi mào bằng cách nhóm lửa (đốt một góc tờ giấy trước, đốt cháy một góc lò than trước).
Vận dụng 3 trang 83 Hóa học 10: Vì sao khi nung vôi người ta phải xếp đá vôi lẫn với than trong lò?
Lời giải:
Khi nung vôi người ta phải xếp đá vôi lẫn với than trong lò vì:
- Phản ứng đốt cháy than là phản ứng tỏa nhiệt.
- Phản ứng nung vôi là phản ứng thu nhiệt.
- Nhiệt tỏa ra trong quá trình đốt cháy than sẽ cung cấp cho quá trình nung vôi.
Câu hỏi 2 trang 84 Hóa học 10: Phản ứng đốt cháy cồn hay phản ứng nung vôi dễ thực hiện hơn?
Lời giải:
Phản ứng đốt cháy cồn là phản ứng tỏa nhiệt.
Phản ứng nung vôi là phản ứng thu nhiệt.
Các phản ứng tỏa nhiệt thường diễn ra thuận lợi hơn các phản ứng thu nhiệt.
⇒ Phản ứng đốt cháy cồn dễ thực hiện hơn.
Câu hỏi 3 trang 84 Hóa học 10: CaSO4 là thành phần chính của thạch cao. Biết rằng:
2CaSO4(s) → 2CaO(s) + 2SO2(g) + O2(g) có ∆r = 1000,6 kJ.
a) Phản ứng này diễn ra thuận lợi hay không thuận lợi?
b) Giải thích vì sao trong xây dựng, người ta sử dụng thạch cao để chế tạo các tấm vật liệu chịu nhiệt, chống cháy.
Lời giải:
a) Phản ứng này không thuận lợi vì có ∆r = 1000,6 kJ > 0
Ở điều kiện chuẩn, phản ứng chỉ xảy ra khi được đốt nóng (cung cấp nhiệt), dừng đốt nóng phản ứng sẽ dừng lại.
b) ∆r = 1000,6 kJ > 0 nên cần cung cấp một nhiệt lượng lớn thạch cao mới có thể bị phân hủy.
⇒ Thạch cao bền với nhiệt
⇒ Trong xây dựng, người ta sử dụng thạch cao để chế tạo các tấm vật liệu chịu nhiệt, chống cháy.
II. Cách tính biến thiên enthalpy phản ứng
Vận dụng 4 trang 85 Hóa học 10: Cho biết:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l) có ∆r = 91,6 kJ
NaHCO3 có trong thành phần bột nở dùng để làm bánh. Vì sao khi bảo quản, cần tránh để bột nở ở nơi có nhiệt độ cao?
Lời giải:
∆r = 91,6 kJ > 0 nên phản ứng này thu nhiệt. Khi gặp nhiệt độ cao bột nở NaHCO3 dễ dàng bị phân hủy.
Lời giải:
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g)
∆r = 2 × ∆f (CO2) + 2 × ∆f (H2O) – 1 × ∆f (C2H4) – 3 × ∆f (O2)
∆r = 2 × (-393,5) + 2 × (-241,8) – 1 × 52,4 – 3 × 0 = -1323 kJ
C2H6(g) + O2(g) → 2CO2(g) + 3H2O(g)
∆r = 2 × ∆f (CO2) + 3 × ∆f (H2O) – 1 × ∆f (C2H6) – × ∆f (O2)
∆r = 2 × (-393,5) + 3 × (-241,8) – 1 × (-84) - × 0 = -1428,4 kJ
CO (g) + O2(g) → CO2(g)
∆r = 1 × ∆f (CO2) – 1 × ∆f (CO) – × ∆f (O2)
∆r = 1 × (-393,5) - 1 × (-110,5) - × 0 = -283 kJ
Câu hỏi 4 trang 85 Hóa học 10: Cho phản ứng sau ở điều kiện chuẩn:
H-H(g) + F-F(g) → 2H-F(g)
Tính năng lượng cần để phá vỡ các liên kết trong H2, F2 và năng lượng tỏa ra (theo kJ) khi hình thành liên kết trong HF cho phản ứng trên.
Lời giải:
∆r = EH-H + EF-F – 2.FH-F
∆r = 436 + 159 – 2.565 = -535 kJ
Lời giải:
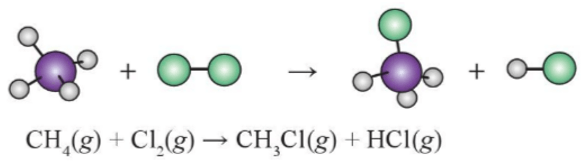
Ta có phản ứng:
Phân tử CH4 gồm 4 liên kết C-H
Phân tử Cl2 gồm 1 liên kết Cl-Cl
Phân tử CH3Cl gồm 3 liên kết C-H và 1 liên kết C-Cl
Phân tử HCl gồm 1 liên kết H-Cl
Luyện tập 3 trang 86 Hóa học 10: Dựa vào năng lượng liên kết, tính ∆r các phản ứng sau:
a) Các phản ứng đốt cháy hoàn toàn 1 mol mỗi chất C2H4, C2H6, H2 ở thể khí.
b) F2(g) + H2O(g) → 2HF(g) + O2(g)
Dự đoán các phản ứng trên là thuận lợi hay không thuận lợi.
Lời giải:
a) C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g)
∆r = 1 × Eb(C2H4) + 3 × Eb(O2) – 2 × Eb(CO2) – 2 × Eb(H2O)
∆r = 1 × (1EC=C + 4EC-H) + 3 × EO=O – 2 × 2EC=O – 2 × 2 × EO-H
∆r = 1 × (611 + 4 × 414) + 3 × 498 – 2 × 2 × 799 – 2 × 2 × 464
∆r = -1291 kJ < 0
⇒ Phản ứng này là thuận lợi
C2H6(g) + O2(g) → 2CO2(g) + 3H2O(g)
∆r = 1 × Eb(C2H6) + × Eb(O2) – 2 × Eb(CO2) – 3 × Eb(H2O)
∆r =1 × (1EC-C + 6EC-H) + × Eb(O2) – 2 × 2EC=O – 3 × 2 × EO-H
∆r = 1 × (347 + 6 × 414) + × 498 – 2 × 2 × 799 – 3 × 2 × 464
∆r = -1406 kJ < 0
⇒ Phản ứng này là thuận lợi
H2(g) + O2(g) → H2O(g)
∆r = 1 × Eb(H2) + × Eb(O2) – 1 × Eb(H2O)
∆r = 1 × EH-H + × Eb(O2) – 1 × 2 × EO-H
∆r = 1 × 436 + × 498 – 1 × 2 × 464 = -243 kJ < 0
⇒ Phản ứng này là thuận lợi
b) F2(g) + H2O(g) → 2HF(g) + O2(g)
∆r = 1 × E(F2) + 1 × E(H2O) - 2 × E(HF) - × E(O2)
∆r = 1 × EF-F + 1 × 2 × EO-H - 2 × EH-F - × E(O2)
∆r = 1 × 159 + 1 × 2 × 464 - 2 × 565 - × 498 = -292 kJ < 0
⇒ Phản ứng này là thuận lợi.
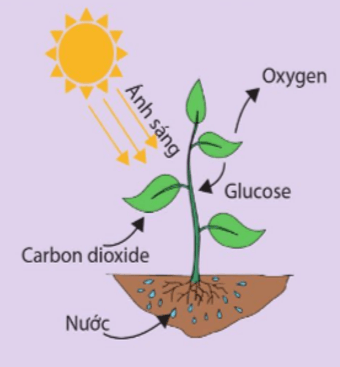
Vận dụng 5 trang 86 Hóa học 10: Phản ứng quang hợp là phản ứng thu năng lượng dưới dạng ánh sáng:
6CO2(g) + 6H2O(l) → C6H12O6 (s) + 6O2(g)
Hãy tính xem cần phải cung cấp bao nhiêu năng lượng dưới dạng ánh sáng cho những phản ứng quang hợp để tạo thành 1 mol glucose C6H12O6(s), biết enthalpy tạo thành chuẩn của chất này là -1271,1 kJ mol-1. Biến thiên enthalpy tạo thành chuẩn của các chất khác được cho ở phụ lục 3.
Lời giải:
Để tạo thành 1 mol glucose C6H12O6(s) ta có
6CO2(g) + 6H2O(l) → C6H12O6(s) + 6O2(g)
∆r = 1 × ∆f (C6H12O6) + 6 × ∆f (O2) – 6 × ∆f (CO2) – 6 × ∆f (H2O)
∆r = 1 × (-1271,1) + 6 × 0 – 6 × (-393,5) – 6 × (-285,8) = 2804,7 kJ
Vậy cần phải cung cấp năng lượng là 2804,7 kJ dưới dạng ánh sáng cho những phản ứng quang hợp để tạo thành 1 mol glucose C6H12O6(s).
Bài tập (trang 87)
Biết ∆f (HgO(s)) = -90,5 kJ mol-1
Lời giải:
2HgO(s) → 2Hg(l) và O2(g)
∆r = 2.∆f (Hg(l)) + ∆f (O2(g)) – 2.∆f (HgO(s))
∆r = 2.0 + 0 – 2.(-90,5) = 181 kJ
Vậy để điều chế được 1 mol O2 theo phương pháp này cần cung cấp 181 kJ nhiệt lượng.
Bài 2 trang 87 Hóa học 10: Tính ∆r cho phản ứng sau dựa theo năng lượng liên kết.
CH4(g) + X2(g) → CH3X(g) + HX(g)Với X = F, Cl, Br, I.
Liên hệ giữa mức độ phản ứng (dựa theo ∆f ) với tính phi kim (F > Cl > Br > I). Tra các giá trị năng lượng liên kết ở Phụ lục 2, trang 119.
Lời giải:
CH4(g) + F2(g) → CH3F(g) + HF(g)
∆r = Eb(CH4) + Eb(F2) – Eb(CH3F) – Eb(HF)
∆r = 4EC-H + EF-F – (3EC-H + EC-F) – EH-F
∆r = 4.414 + 159 – (3.414 + 485) – 565 = -477 kJ
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
∆r = Eb(CH4) + Eb(Cl2) – Eb(CH3Cl) – Eb(HCl)
∆r = 4EC-H + ECl-Cl – (3EC-H + EC-Cl) – EH-Cl
∆r = 4.414 + 243 – (3.414 + 339) – 431 = -113 kJ
CH4(g) + Br2(g) → CH3Br(g) + HBr(g)
∆r = Eb(CH4) + Eb(Br2) – Eb(CH3Br) – Eb(HBr)
∆r = 4EC-H + EBr-Br – (3EC-H + EC-Br) – EH-Br
∆r = 4.414 + 193 – (3.414 + 276) – 364 = -33 kJ
CH4(g) + I2(g) → CH3I(g) + HI(g)
∆r = Eb(CH4) + Eb(I2) – Eb(CH3I) – Eb(HI)
∆r = 4EC-H + EI-I – (3EC-H + EC-I) – EH-I
∆r = 4.414 + 151 – (3.414 + 240) – 297 = 28 kJ
Theo chiều giảm dần tính phi kim (F > Cl > Br > I) thì ∆f của mỗi phản ứng tăng dần
⇒ Tính phi kim càng mạnh, phản ứng diễn ra càng thuận lợi.
Lời giải:
Khi đun bếp than, củi, để đun nấu nhanh hơn, người ta thường dùng quạt để thổi thêm không khí vào bếp (cung cấp thêm O2) giúp phản ứng diễn ra nhanh hơn, C được cháy hoàn toàn
Tuy nhiên cách làm này không làm thay đổi biến thiên enthalpy chuẩn của phản ứng
∆r = ∆f (CO2(g)) - ∆f (C(s)) – 3.∆f (O2(g))
Enthalpy tạo thành chuẩn của đơn chất luôn bằng 0
⇒ ∆r không phụ thuộc vào ∆f (O2(g))
Xem thêm lời giải bài tập SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 13: Phản ứng oxi hóa – khử
Bài 14: Phản ứng hóa học và enthalpy
Bài 16: Tốc độ phản ứng hóa học
Bài 17: Nguyên tố và đơn chất halogen
Bài 18: Hydrogen halide và hydrohalic acid