a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính của các ion kim loại tương ứng
409
02/06/2023
Bài 3 trang 56 Hóa học 10:
a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính của các ion kim loại tương ứng.
b) Vì sao cả Na2O và MgO đều là chất rắn ở điều kiện thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
Trả lời
a) Nguyên tử kim loại có 1, 2, 3 electron lớp ngoài cùng, có xu hướng nhường 1, 2, 3 electron này để đạt cấu hình bền vững giống như khí hiếm. Khi nhường electron các ion kim loại mất đi 1 lớp electron ngoài cùng. Do đó bán kính ion kim loại nhỏ hơn bán kính nguyên tử kim loại tương ứng.
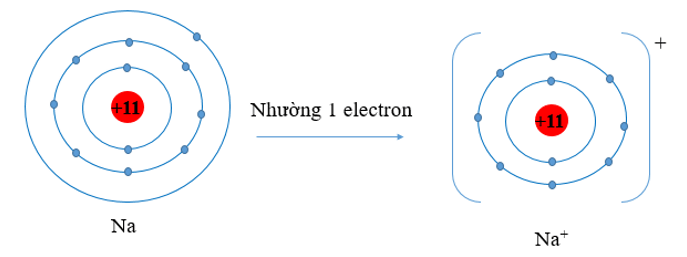
- Nguyên tử Na có 3 lớp electron, 1 electron lớp ngoài cùng. Nguyên tử Na đã nhường đi 1 electron ở lớp thứ 3 để trở thành ion Na+. Khi đó ion Na+ chỉ còn 2 lớp electron
⇒ Bán kính Na+ nhỏ hơn bán kính nguyên tử Na.
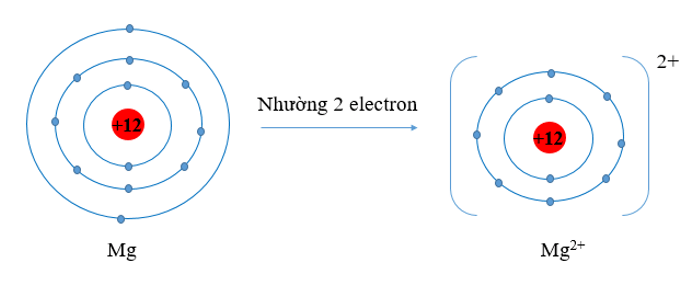
- Nguyên tử Mg có 3 lớp electron, 2 electron lớp ngoài cùng. Nguyên tử Mg đã nhường đi 2 electron ở lớp thứ 3 để trở thành ion Mg2+. Khi đó ion Mg2+ chỉ còn 2 lớp electron
⇒ Bán kính Mg2+ nhỏ hơn bán kính nguyên tử Mg2+.
b) Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion ⇒ Ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion ⇒ Ở điều kiện thường MgO tồn tại ở thể rắn.
c) Ta có:
+ Bán kính ion Na+ > bán kính ion Mg2+
+ Điện tích ion Mg2+ > điện tích ion Na+
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.
Xem thêm lời giải bài tập SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Bài 9: Quy tắc octet
Bài 10: Liên kết ion
Bài 11: Liên kết cộng hóa trị
Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa – khử


