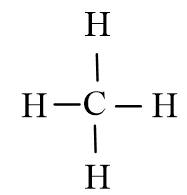
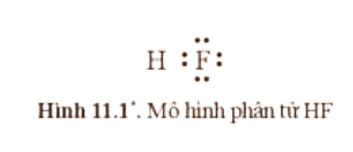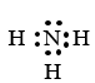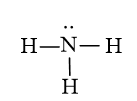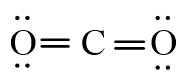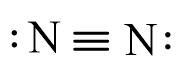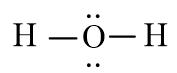Giải Hóa học 10 Bài 11: Liên kết cộng hóa trị
Lời giải:
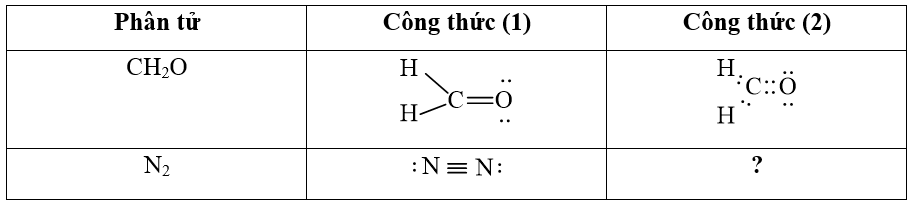
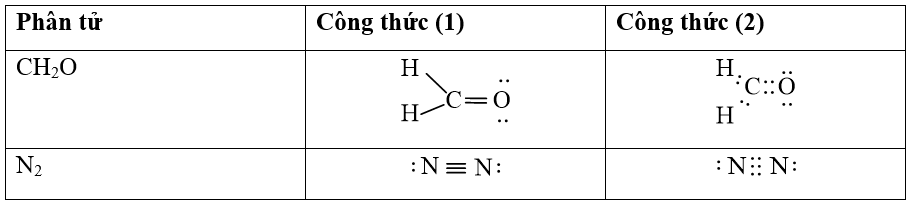
Công thức (2) của nguyên tử N có thể hiện được quy tắc octet. Mỗi nguyên tử N trong phân tử N2 có 8 electron lớp ngoài cùng, trong đó có 3 cặp electron chung giữa hai nguyên tử.
I. Liên kết cộng hóa trị
Lời giải:
Trong phân tử HF có 2 electron dùng chung.
Nguyên tử H không có electron hóa trị riêng.
Nguyên tử F có 6 electron hóa trị riêng.
Lời giải:
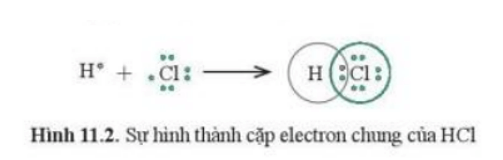
H có cấu hình electron là 1s1 ⇒ Có 1 electron lớp ngoài cùng.
Cl có cấu hình electron là [Ne]3s23p5 ⇒ Có 7 electron lớp ngoài cùng.
Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron chung cho cả hai nguyên tử.
Khi đó trong phân tử HCl, lớp electron ngoài cùng của Cl và H lần lượt là 8 và 2 electron.
Lời giải:
- Mô hình này không hợp lí trong thực tế. Để tạo ion F7+ cần một năng lượng rất lớn so với tạo F-.
- Mô tả hình thành liên kết trong phân tử F2:
Nguyên tử F có cấu hình electron: 1s22s22p5. Để đạt được cấu hình electron của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy mỗi nguyên tử F cùng góp 1 electron để tạo nên một cặp electron chung cho cả phân tử.
:. .F. .. + :. .F. .. → :. .F. .: . .F. .:
Lời giải:
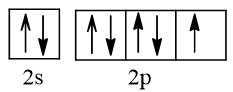
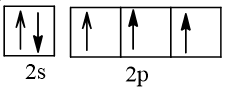
Nguyên tử N (Z = 7) có cấu hình electron là 1s22s22p3
Nguyên tử H (Z = 1) có cấu hình electron là 1s1
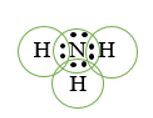
Để đạt được cấu hình của khí hiếm gần nhất, nguyên tử N cần thêm 3 electron, nguyên tử H cần thêm 1 electron. Vì vậy mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử N để tạo thành 3 cặp electron chung.
Các cặp electron chung cho phân tử NH3
Công thức electron:
Công thức Lewis:
Lời giải:
Công thức Lewis của CO2
Giữa nguyên tử carbon và mỗi nguyên tử oxygen có 2 cặp electron chung.
Lời giải:
Nguyên tử N (Z = 7) có cấu hình electron là: 1s22s22p3
Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử N đều cần thêm 3 electron. Vì vậy, mỗi nguyên tử N góp chung 3 electron để tạo nên 3 cặp electron chung cho cả hai nguyên tử.
Công thức Lewis của N2
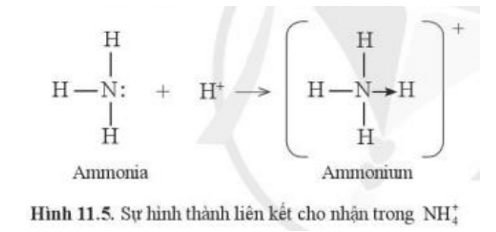
Câu hỏi 6 trang 59 Hóa học 10: Những nguyên tử nào trong cation ammonium thỏa mãn quy tắc octet?
Lời giải:
Cả nguyên tử N và các nguyên tử H đều thỏa mãn quy tắc octet.
Lời giải:
Liên kết giữa nguyên tử N trong NH3 với H+ không phải là liên kết ion vì cặp electron vẫn được dùng chung cho cả nguyên tử N và H chứ chưa bị lệch hoàn toàn về phía nguyên tử nào.
Chú ý:
- Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Liên kết cho nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử (liên kết cho nhận là trường hợp đặc biệt của liên kết cộng hóa trị)
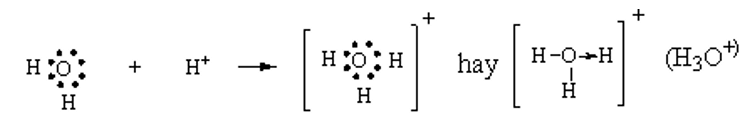
Luyện tập 2 trang 59 Hóa học 10: Trình bày sự hình thành ion hydronium (H3O+) từ H2O và H+.
Lời giải:
Trên nguyên tử O còn 2 cặp electron riêng, khi hình thành H3O+, O sẽ sử dụng 1 cặp electron riêng này trở thành cặp electron chung cho cả O và H, cả O và các H đều thỏa mãn quy tắc octet. Như vậy, liên kết đơn giữa nguyên tử O trong H2O và H+ được tạo thành bởi một cặp electron góp chung của nguyên tử O.
II. Phân loại liên kết theo độ âm điện
Lời giải:
H2S
∆χ = χ(S) – χ(H) = 2,58 – 2,20 = 0,38
Nên liên kết giữa nguyên tử S và H là liên kết cộng hóa trị không cực.
CH4
∆χ = χ(C) – χ(H) = 2,55 – 2,20 = 0,35
Nên liên kết giữa nguyên tử C và H là liên kết cộng hóa trị không cực.
K2O
∆χ = χ(O) – χ(K) = 3,44 – 0,82 = 2,62
Nên liên kết giữa nguyên tử O và K là liên kết ion.
F2O
∆χ = χ(F) – χ(O) = 3,98 – 3,44 = 0,54
Nên liên kết giữa nguyên tử F và O là liên kết cộng hóa trị có cực.
NaBr
∆χ = χ(Br) – χ(Na) = 2,96 – 0,93 = 2,03
Nên liên kết giữa nguyên tử Br và Na là liên kết ion.
III. Liên kết sigma (σ) và liên kết pi (π)
Lời giải:
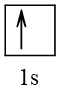
Ô orbital lớp ngoài cùng của H (Z = 1) là:
Ô orbital lớp ngoài cùng của F (Z = 9) là:
Hai AOs của H xen phủ trục với nhau tạo liên kết đơn trong các phân tử H2
Hai AOp của F xen phủ trục với nhau tạo liên kết đơn trong các phân tử F2
Một AOs của H xen phủ trục với một AOp của F tạo liên kết đơn trong phân tử HF
Lời giải:
Nguyên tử N (Z = 7) có cấu hình electron là 1s22s22p3
Ô orbital lớp ngoài cùng của N (Z = 7) là:
Mỗi nguyên tử N có 3 AOp. Khi hình thành liên kết trong phân tử N2, 2 AO pz xen phủ trục với nhau tạo 1 liên kết σ, 2 AO py xen phủ bên với nhau tạo 1 liên kết π, 2AO px xen phủ bên với nhau tạo 1 liên kết π.
Như vậy hai nguyên tử N liên kết với nhau bằng một liên kết ba tạo phân tử N2 trong đó có 1 liên kết σ và 2 liên kết π.
IV. Năng lượng của liên kết cộng hóa trị
Vận dụng trang 62 Hóa học 10: Xây dựng mô hình phân tử.
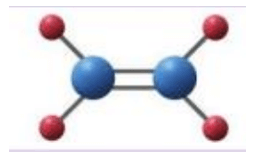
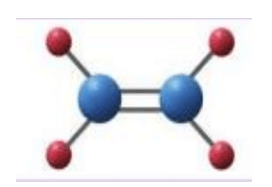
Sử dụng đất sét nặn (hoặc hộp xây dựng mô hình) để tạo hình nguyên tử và các đoạn ống hút để biểu diễn liên kết hóa học. Xây dựng mô hình các phân tử: CH2=CH2, CHCl=CHCl. Biết rằng các nguyên tử đều nằm trên cùng một mặt phẳng
Lời giải:
Học sinh tự thiết kế theo mô hình được minh họa như sau:
Mô hình phân tử CH2=CH2:
Mô hình phân tử CHCl=CHCl:
Lời giải:
Sắp xếp năng lượng của các loại liên kết của cùng một cặp nguyên tố theo chiều tăng dần: Năng lượng liên kết đơn (năng lượng liên kết đôi) liên kết ba của cùng một cặp nguyên tố tăng dần.
Do liên kết đơn chỉ gồm các liên kết sigma, liên kết đôi gồm 1 liên kết sigma và 1 liên kết pi còn liên kết ba gồm 1 liên kết sigma và 2 liên kết pi.
Bài tập (trang 63)
Bài 1 trang 63 Hóa học 10: Những phát biểu nào sau đây là đúng?
(a) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử khi đó là liên kết cộng hóa trị không cực.
(b) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(c) Cặp electron dùng chung luôn được tạo nên từ 2 electron của cùng một nguyên tử.
(d) Cặp electron dùng chung được tạo nên từ 2 electron hóa trị.
Lời giải:
Phát biểu đúng là: (b), (d)
(a) Sai.
Sửa lại:
Nếu cặp electron chung bị lệch về phía một nguyên tử khi đó là liên kết cộng hóa trị có cực.
(b) Đúng.
(c) Sai
Sửa lại:
Cặp electron chung có thể được tạo nên từ 2 electron của cùng một nguyên tử (liên kết cho nhận) hoặc được tạo nên từ 2 electron của hai nguyên tử khác nhau, trong đó mỗi nguyên tử góp chung 1 electron.
(d) Đúng.
Bài 2 trang 63 Hóa học 10: Những phát biểu nào sau đây là đúng?
(a) Liên kết đôi được tạo nên từ hai liên kết σ.
(b) Liên kết ba được tạo nên từ 2 liên kết σ và 1 liên kết π.
(c) Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
(d) Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Lời giải:
Phát biểu đúng: (c), (d)
Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Lời giải:
Công thức Lewis của H2O:
Phân tử H2O có 2 cặp electron hóa trị riêng.
Công thức Lewis của CH4
Phân tử CH4 không có cặp electron hóa trị riêng.
Bài 4 trang 63 Hóa học 10: Sử dụng bảng giá trị năng lượng liên kết ở phụ lục 2:
a) Hãy tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ để bắt đầu phá vỡ liên kết (nhiệt độ phân hủy) mỗi chất trong hai chất trên ứng với một trong hai nhiệt độ sau: 400oC hoặc 1 000oC. Em hãy dự đoán nhiệt độ phân hủy của chất nào cao hơn. Vì sao?
Lời giải:
a)
- Công thức phân tử của H2S là H-S-H
⇒ Phân tử H2S gồm hai liên kết S-H.
Tổng năng lượng liên kết trong phân tử H2S là: 2.368 = 736 kJ mol-1
- Công thức phân tử của H2O là H-O-H
⇒ Phân tử H2O gồm hai liên kết O-H
Tổng năng lượng liên kết trong phân tử H2O là: 2.464 = 928 kJ mol-1
b) Năng lượng liên kết trong phân tử H2O lớn hơn H2S (928 kJ mol-1 > 736 kJ mol-1)
⇒ Nhiệt độ để bắt đầu phá vỡ liên kết (nhiệt độ phân hủy) H2O lớn hơn H2S
⇒ Nhiệt độ phân hủy của H2O là 1000oC, của H2S là 400oC
Lời giải:
Năng lượng liên kết F-F là 159 kJ mol-1
Năng lượng liên kết N≡N là 946 kJ mol-1
⇒ Năng lượng cần để phá vỡ liên kết N≡N lớn hơn năng lượng cần để phá vỡ liên kết F-F
⇒ Phản ứng của F2 với H2 sẽ thuận lợi hơn.
Xem thêm lời giải bài tập SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết hydrogen và tương tác Van Der Waals