Phương trình C6H6 + HNO3 → C6H5NO2 + H2O
1. Phản ứng Benzen tác dụng HNO3
C6H6 + HNO3 → C6H5NO2 + H2O
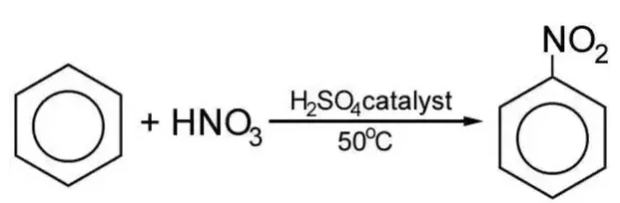
2. Điều kiện để phản ứng C6H6 ra C6H5NO2
Điều kiện: Nhiệt độ, H2SO4
3. Bản chất của C6H6 (Benzen) trong phản ứng
Khi Benzen tác dụng với hỗn hợp H2SO4 đậm đặc và HNO3 đặc sẽ tạo thành nitrobenzen. Đây là phản ứng nitro hoá
4. Tính chất hóa học
4.1. Tính chất của Benzen
Tính chất vật lí
Bezen là chất lỏng, không màu, có mùi thơm đặc trưng nhẹ hơn nước và không tan trong nước.
Tính chất hóa học Benzen
Tính chất hóa học nổi bật của benzen là phản ứng thế, phản ứng cộng và phản ứng oxi hóa. Và đây cũng là 3 tính chất hóa học phổ biến của các chất thuộc đồng đẳng benzen hoặc các hiđrocacbon thơm.
- Phản ứng thế
C6H6+ Br2 → C6H5Br + HBr (Fe, to)
C6H6 + HNO3 → C6H5NO2 + H2O (H2SO4 đặc, to)
- Phản ứng cộng
C6H6 + 3H2 → xiclohexan (Ni, to)
C6H6 + 3Cl2 → C6H6Cl6 (as) (hexacloran hay 666 hay 1,2,3,4,5,6 - hexacloxiclohexan)
- Phản ứng oxi hóa
Benzen không làm mất màu dung dịch KMnO4.
- Oxi hóa hoàn toàn
C6H6 + 7,5O2 → 6CO2+ 3H2O (to)
4.2. Tính chất hóa học của HNO3
Tính axit
Là một trong số các axit mạnh nhất, trong dung dịch:
HNO3 → H+ + NO3-
Dung dịch axit HNO3 có đầy đủ tính chất của môt dung dịch axit: làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
Tính oxi hóa
Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
Với kim loại: HNO3 oxi hóa hầu hết các kim loại (trừ vàng (Au) và platin(Pt))
Với những kim loại có tính khử yếu: Cu, Ag, ...
Ví dụ:
Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
Khi tác dụng với những kim loại có tính khử mạnh hơn: Mg, Zn, Al, ...: HNO3 đặc bị khử đến NO2.
Ví dụ:
Mg + 4HNO3(đ) → Mg(NO3)2 + 2NO2 + 2H2O.
- HNO3 loãng bị khử đến N2O hoặc N2.
8Al + 30HNO3(l) → 8Al(NO3)3 + 3N2O + 15H2O
- HNO3 rất loãng bị khử đến NH3(NH4NO3).
4Zn + 10HNO3 (rất loãng) → 4Zn(NO3)2 + NH4NO3 + 3H2O
* Lưu ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc nguội.
- Với phi kim:
Khi đun nóng HNO3 đặc có thể tác dụng với phi: C, P, S, …(trừ N2 và halogen).
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
- Với hợp chất:
H2S, HI, SO2, FeO, muối sắt (II), … có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn.
Ví dụ:
3FeO + 10HNO3(đ) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(đ) → 3S + 2NO + 4H2O
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông, … bốc cháy khi tiếp xúc với HNO3 đặc.
5. Điều chế benzen
Từ axetilen:
3C2H2 → C6H6 (C, 600oC)
Tách H2 từ xiclohexan:
C6H12→ C6H6 + 3H2 (to, xt)
6. Bài tập vận dụng
Câu 1. Hóa chất để phân biệt benzen, axetilen và stiren là
A. Cu(OH)2, dung dịch AgNO3/NH3
B. dung dịch brom, dung dịch AgNO3/NH3
C. dung dịch brom
D. dung dịch AgNO3/NH3
Lời giải:
Đáp án: B
Câu 2: Dãy đồng đẳng của benzen có công thức chung là:
A. CnH2n+2
B. CnH2n−2
C. CnH2n−4
D. CnH2n−6
Lời giải:
Đáp án: C
Câu 3. Hóa chất để phân biệt: benzen, axetilen, striren là:
A. Dung dịch Br2
B. Dung dịch Br2, Dung dịch AgNO3/NH3
C. Dung dịch AgNO3
D. Cu(OH)2, dung dịch AgNO3/NH3
Lời giải:
Đáp án: B
Giải thích:
Trích mẫu thử và đánh số thứ tự
Khi cho KMnO4 ở điều kiện thường vào lần lượt các ống nghiệm
Ống đựng axetilen và stiren làm nhạt màu KMnO4.
Ống đựng benzen không hiện tượng.
Cho tiếp 2 dung dịch axetilen và stiren vào dung dịch AgNO3/ NH3, đun nóng
Ống đựng axetilen có lớp Ag màu trắng xám
Ống đựng stiren không hiện tượng.
Câu 4. Hiện tượng gì xảy ra khi cho brom lỏng vào ống nghiệm chứa benzen, lắc rồi để yên?
A. Có khí thoát ra
B. Dung dịch tách thành 2 lớp
C. Xuất hiện kết tủa
D. Dung dịch đồng nhất.
Lời giải:
Đáp án: D
Câu 5: Chất nào sau đây có khả năng tham gia trùng hợp tạo polime?
A. benzen
B. toluen
C. propan
D. striren
Lời giải:
Đáp án: B
Xem thêm các phương trình hóa học khác:
C3H4 ra C3H3Ag l C3H4 + AgNO3 + NH3 → C3H3Ag + NH4NO3
C2H2 → C6H6 | C2H2 ra C6H6 | axetilen ra benzen | Trime hóa C2H2
C2H2 + AgNO3 + NH3 → C2Ag2 + NH4NO3 | C2H2 ra C2Ag2
CaC2 + H2O → C2H2 + Ca(OH)2 | CaC2 ra C2H2
C2H2 + H2O → CH3CHO | axetilen + nước | C2H2 ra CH3CHO




