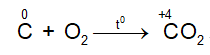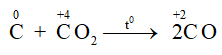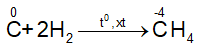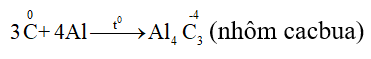Phản ứng C + H2 → C2H2
1. Phương trình điều chế C2H2 từ C và H2
C + H2 C2H2
2. Điều kiện phương trình phản ứng xảy ra
Điều kiện: Nhiệt độ.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của C (Cacbon)
- Trong phản ứng trên C là chất oxi hoá.
- C thể hiện tính oxi hoá khi tác dụng với hidro, kim loại...
3.2. Bản chất của H2 (Hidro)
- Trong phản ứng trên H2 là chất khử.
- Hidro có thể phản ứng với phi kim ở nhiệt độ cao.
4. Tính chất hóa học của C
- Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
- Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
4.1. Tính khử
- Tác dụng với oxi
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
4.2. Tính oxi hóa
- Tác dụng với hidro
- Tác dụng với kim loại
5. Bài tập vận dụng
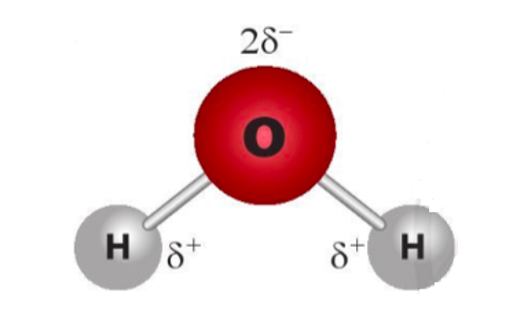
Câu 1. Cho sự phân bố điện tích trong phân tử H2O dưới đây. Liên kết giữa hai phân tử H2O có thể được hình thành qua cặp nguyên tử
A. O với O
B. O với H
C. H với H
D. Cả A, B và C.
Lời giải:
Đáp án: B
Liên kết giữa hai phân tử H2O có thể được hình thành qua nguyên tử H mang điện tích dương của phân tử H2O này với nguyên tử O mang điện tích âm của phân tử nước khác.
Vậy liên kết hình thành qua cặp nguyên tử O với H.
Câu 2. Loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng là
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết hydrogen
Lời giải:
Đáp án: D
Liên kết hydrogen là loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
Câu 3. Tính chất vật lý của axetilen là
A. chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí.
B. chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. chất khí không màu, không mùi, tan tốt trong nước, nhẹ hơn không khí .
D. chất khí không màu, mùi hắc, ít tan trong nước, nặng hơn không khí.
Lời giải:
Đáp án: B
Câu 4. Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây
A. CH4
B. NH3
C. H3C – O – CH3
D. PH3
Lời giải:
Đáp án: B
CH4: nguyên tử C không có cặp electron hóa trị riêng nên không xuất hiện liên kết hydrogen giữa các phân tử CH4.
NH3: nguyên tử N có cặp electron hóa trị riêng và nguyên tử H liên kết với nguyên tử N có độ âm điện lớn ⇒ xuất hiện liên kết hydrogen giữa các phân tử NH3
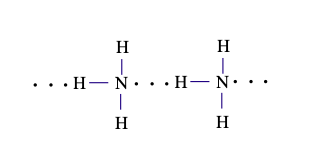
H3C – O – CH3, PH3: nguyên tử H không liên kết với nguyên tử có độ âm điện lớn nên không xuất hiện liên kết hydrogen giữa các phân tử.
Câu 5. Hãy cho biết trong các chất sau: C2H4, C3H4, C2H6, C2H2 có bao nhiêu chất làm mất màu dung dịch brom?
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án: C
Câu 6. Nguyên tử H trong phân tử H2O không tạo được liên kết hydrogen với
A. nguyên tử N trong phân tử NH3
B. nguyên tử F trong phân tử HF
C. nguyên tử O trong phân tử H2O
D. nguyên tử C trong phân tử CH4
Lời giải:
Đáp án: D
Công thức electron của các phân tử NH3; HCl; HF; CH4 lần lượt là:
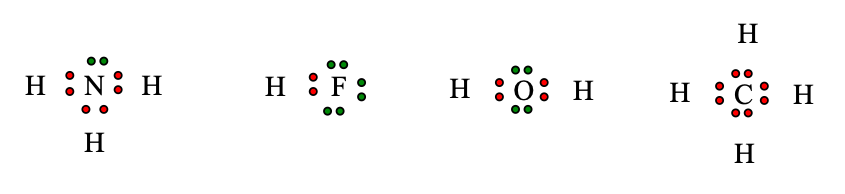
Nguyên tử C trong phân tử CH4 không còn cặp electron hóa trị riêng nên nguyên tử H trong phân tử H2O không tạo được liên kết hydrogen với nguyên tử C trong phân tử CH4
Câu 7. Cho luồng khí CO (dư) đi qua 4,8 gam hỗn hợp X gồm CuO và Fe2O3 (tỉ lệ mol là 1:1) nung nóng đến khi phản ứng hoàn toàn, thu được m gam chất rắn. Giá trị của m là
A. 3,52.
B. 4,48.
C. 2,40.
D. 4,16.
Lời giải:
Đáp án: A
Gọi số mol của CuO và Fe2O3 là a mol
Ta có:
a=4,880+160=0,02 mol
Phương trình hóa học:
CuO + CO →t° Cu + CO2
0,02 0,02
Fe2O3 + 3CO 2Fe + 2CO2
0,02 0,04
→ mchất rắn = mCu + mFe = 0,02.64 + 0,04.56 = 3,52 gam
Câu 8. Liên kết hydrogen ảnh hưởng tới tính chất của nước như
A. đặc điểm tập hợp
B. nhiệt độ nóng chảy
C. nhiệt độ sôi
D. Cả A, B và C
Lời giải:
Đáp án: D
Liên kết hydrogen ảnh hưởng tới tính chất của nước như: đặc điểm tập hợp, nhiệt độ nóng chảy và nhiệt độ sôi.
Câu 9. Nguyên nhân dẫn tới sự phân cực của các phân tử HCl, SO2, … là do
A. liên kết ion
B. liên kết cộng hóa trị không cực
C. liên kết cộng hóa trị có cực
D. liên kết hydrogen
Lời giải:
Đáp án: C
Nguyên nhân dẫn tới sự phân cực của các phân tử HCl, SO2, … là do liên kết cộng hóa trị có cực.
Câu 10. Phân tử nào dưới đây không có cực
A. HCl
B. CO2
C. H2O
D. NH3
Lời giải:
Đáp án: B
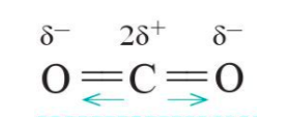
Liên kết C = O trong phân tử CO2 là liên kết có cực. Tuy nhiên phân tử CO2 có cấu tạo thẳng, hai liên kết C = O lại có cực ngược chiều nhau nên triệt tiêu lẫn nhau khi xét cho cả phân tử. Do đó phân tử CO2 không có cực.
Xem thêm các phương trình hóa học khác:
C + H2SO4 → SO2 + CO2 + H2O | C ra SO2